Los ácidos son sustancias muy familiares. Se caracterizan por tener átomos de hidrógeno (rojo) unidos a átomos muy electronegativos como el oxígeno (azul) o el cloro (verde).
| CH3-COOH | (HOOC-CH2)2C(OH)COOH
| HCl | CH3CH(OH)COOH |
|---|
| | | |
| El ácido acético está en el vinagre | El ácido cítrico está en el jugo de naranja o limón | El ácido clorhídrico está en el jugo gástrico | El ácido láctico está en la leche |
Tienen un sabor característico. Algunos son demasiado fuertes y peligrosos como para probarlos. Los átomos de hidrógeno unidos a átomos electronegativos se desprenden con facilidad. Esa es la característica química que hace que un ácido lo sea.
 Quemadura simulada
Quemadura simulada
Un enlace entre dos átomos de una molécula puede romperse de dos formas:
Los dos electrones del enlace se reparten entre los dos átomos inicialmente enlazados. Esta ruptura es generalmente muy difícil.
Los dos electrones del enlace se quedan del lado del átomo más electronegativo de los dos que forman el enlace. Esta es la forma más común.
Cuando el hidrógeno está unido a un átomo de electronegatividad moderada, la ruptura es homolítica (muy difícil).
Cuando el hidrógeno está unido a un átomo de elevada electronegatividad, la ruptura es heterolítica (mucho más fácil).
Un enlace que se rompe muy fácilmente de forma heterolítica es el que une los átomos electronegativos de una molécula con hidrógeno. El átomo electronegativo se queda con los electrones (ruptura heterolítica) y se desprende un "protón", es decir, un átomo de hidrógeno "desnudo" de electrones. Las moléculas que pierden "protones" con facilidad pertenecen a sustancias que se denominan ácidos.
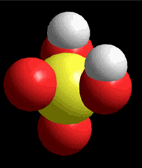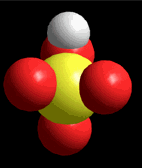 Modelo del ácido sulfúrico (H2SO4) perdiendo un protón
Modelo del ácido sulfúrico (H2SO4) perdiendo un protón
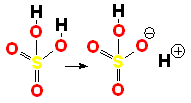 El ácido sulfúrico (H2SO4) es un ácido muy fuerte que pierde un "protón" con facilidad. Cuando la molécula se "queda" con los dos electrones del enlace, adquiere una carga negativa que compensa la carga positiva del "protón".
El ácido sulfúrico (H2SO4) es un ácido muy fuerte que pierde un "protón" con facilidad. Cuando la molécula se "queda" con los dos electrones del enlace, adquiere una carga negativa que compensa la carga positiva del "protón".
Las bases son sustancias también muy familiares. Se caracterizan por tener átomos muy electronegativos como el oxígeno y el nitrógeno (azul) que pueden aceptar protones, aunque ya estén unidos a ellos.
| NaOH | NH3
| NaCO3H | CaCO3 |
|---|
| | | |
| El hidróxido sódico o "sosa" se usa para desatascar tuberías | El amoníaco se usa como producto de limpieza | El bicarbonato sódico es un antiácido estomacal | El carbonato cálcico es el principal constituyente del mármol |
Un enlace que se forma muy fácilmente es el que se establece entre un "protón" y un átomo, de una molécula, con pares de electrones sin compartir. Las moléculas que aceptan "protones" con facilidad pertencen a sustancias que se denominan bases.
Es lógico pensar que los ácidos y las bases reaccionan con facilidad entre sí, traspasándose un "protón".
Los ácidos reaccionan con las bases traspasandose un protón. El producto de la reacción es una sal, formada por un anión (molécula cargada negativamente) y un catión (molécula cargada positivamente).
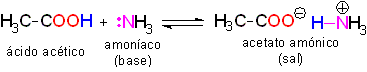 El ácido pierde un protón y la molécula del ácido (neutra originalmente) queda cargada negativamente y se convierte en una base.
El ácido pierde un protón y la molécula del ácido (neutra originalmente) queda cargada negativamente y se convierte en una base.
La base acepta un protón y la molécula de la base (neutra originalmente) queda cargada positivamente y se convierte en un ácido.
El conjunto de anión y catión forma la sal resultante.
 Quemadura simulada
Quemadura simulada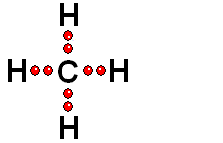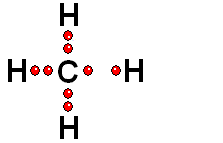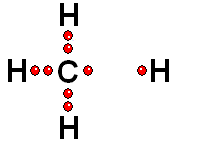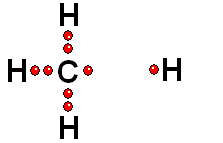
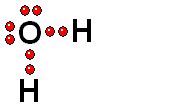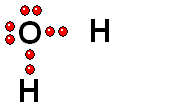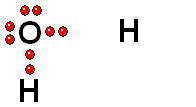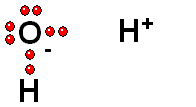
 Modelo del ácido sulfúrico (H2SO4) perdiendo un protón
Modelo del ácido sulfúrico (H2SO4) perdiendo un protón
 El ácido sulfúrico (H2SO4) es un ácido muy fuerte que pierde un "protón" con facilidad. Cuando la molécula se "queda" con los dos electrones del enlace, adquiere una carga negativa que compensa la carga positiva del "protón".
El ácido sulfúrico (H2SO4) es un ácido muy fuerte que pierde un "protón" con facilidad. Cuando la molécula se "queda" con los dos electrones del enlace, adquiere una carga negativa que compensa la carga positiva del "protón".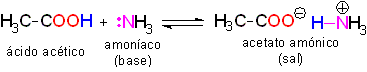 El ácido pierde un protón y la molécula del ácido (neutra originalmente) queda cargada negativamente y se convierte en una base.
El ácido pierde un protón y la molécula del ácido (neutra originalmente) queda cargada negativamente y se convierte en una base.