|
ISÓTOPO: EL
MISMO ELEMENTO CON DIFERENTE NÚMERO DE NEUTRONES
|
Los átomos de un mismo elemento,
que lógicamente tienen el mismo número de protones en el
núcleo, pero que tienen diferente número de neutrones, se
denominan isótopos.
|
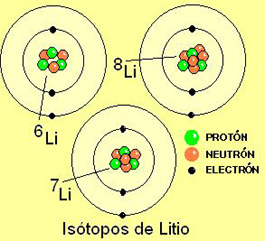
El litio tiene
tres protones en el núcleo y tres electrones en la periferia. Pero
existen tres isótopos del litio que tiene tres, cuatro y cinco neutrones
en el núcleo.
|
Los isótopos de un elemento
tienen el mismo número de protones en el núcleo y de electrones
en la periferia. Sólo se diferencian en el número de neutrones
y, por tanto, en su masa.
|
|
|
|
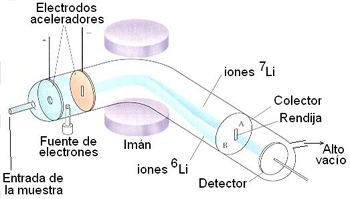
Esquema de un espectrómetro
de masas
|
Los isótopos
de un elemento pueden separarse y detectarse en un espectrómetro
de masas. En un tubo a alto vacío se introduce una pequeña
cantidad de los átomos a analizar en estado gaseoso. Los átomos
pasan por una zona donde un chorro de electrones les arranca un electrón
a cada uno. De esta forma los átomos, al faltarles un electrón,
se convierten en iones con una carga positiva. Continúan viajando
por el tubo y llegan a una zona donde hay un campo magnético de
una cierta intensidad. Los iones experimentan aquí una trayectoria
más o menos curva, en función de su relación masa/carga.
Así, para un cierto campo magnético, sólo los iones
7Li
pueden alcanzar la rendija y se separan de los iones 6Li.
|
|
Si se varía el
campo magnético de forma continua y se registra la señal
eléctrica que llega al detector, veremos que para ciertos valores
del campo se detecta una señal con diferente intensidad, que corresponde
a los diferentes isótopos de un átomo, de masa diferente
al poseer un número de neutrones distinto en el núcleo..
Así obtenemos un espectro de masas de los átomos de Litio
(o de cualquier otro elemento), en el que la intensidad relativa de las
señales indica la diferente abundancia de sus isótopos en
la Naturaleza.
|
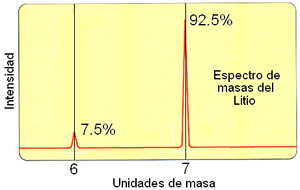
El isótopo 8 del Li (8Li) tiene una abundancia natural muy pequeña y sólo se detecta en aparatos ultrasensibles.
|
|
