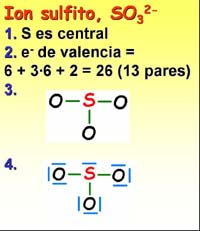
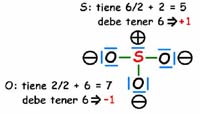
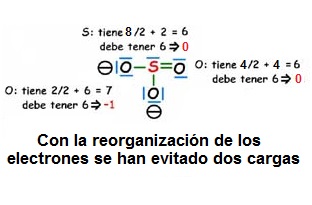
Siguiendo las cuatro reglas anteriores podemos construir una estructura más compleja como la del ion sulfito.
Como la molécula tiene dos cargas negativas, hay que contabilizar dos electrones más de los 24 que aportan los átomos.
1. Se elige el átomo central ¿Cuál es menos electronegativo? ¿Azufre u oxígeno?
2a. Se cuentan los electrones de valencia (más externos) de todos los átomos (1 x S= 6, 3 x O = 18, total 24 electrones ó 12 pares)
2b. Se añaden 2 electrones más por las dos cargas negativas: total 26 electrones ó 13 pares)
3. Se forman enlaces entre el átomo central y los periféricos.
4. Los electrones que "sobran" se colocan sobre los átomos como pares no compartidos (empezando por los más electronegativos).