El Neón (1s2 2s2 2p6) posee dos electrones en el orbital s de la capa 1, dos electrones en el orbital s de la capa 2 y seis electrones en el orbital p de la capa 2. Esta situación electrónica es tan estable que el Neón no se combina con ningún átomo.
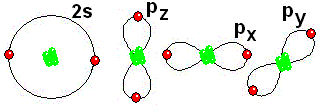 IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.
IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.Los átomos como el Boro, el Carbono, el Nitrógeno y el Oxígeno, que le faltan electrones para adquirir la configuración del Neón, la consiguen compartiendo electrones con otros átomos.
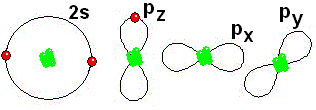 IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.
IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.
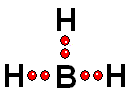 Así se aproxima a su "meta" de tener ocho electrones a su alrededor, como el Neón
Así se aproxima a su "meta" de tener ocho electrones a su alrededor, como el Neón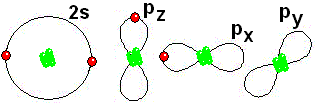 IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.
IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.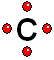 Para estudiar los enlaces entre los átomos sólo interesa considerar los electrones de la capa más externa
Para estudiar los enlaces entre los átomos sólo interesa considerar los electrones de la capa más externa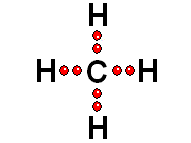 Así logra la "meta" de tener ocho electrones más externos a su alrededor
Así logra la "meta" de tener ocho electrones más externos a su alrededor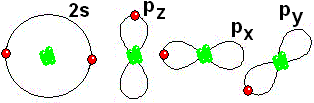 IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.
IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.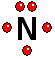 Para estudiar los enlaces entre los átomos sólo interesa considerar los electrones de la capa más externa
Para estudiar los enlaces entre los átomos sólo interesa considerar los electrones de la capa más externa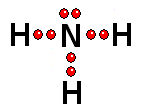 Así logra la "meta" de tener ocho electrones más externos a su alrededor, quedándose con dos electrones sin compartir
Así logra la "meta" de tener ocho electrones más externos a su alrededor, quedándose con dos electrones sin compartir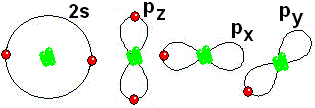 IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.
IMPORTANTE: Los orbitales de la capa 1 se han omitido. Los orbitales de la capa 2 se han separado para dar más claridad al dibujo. Estarían todos superpuestos, alrededor del núcleo de 10 protones.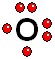 Para estudiar los enlaces entre los átomos sólo interesa considerar los electrones de la capa más externa
Para estudiar los enlaces entre los átomos sólo interesa considerar los electrones de la capa más externa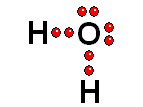 Así logra la "meta" de tener ocho electrones más externos a su alrededor, quedándose con dos pares de electrones sin compartir
Así logra la "meta" de tener ocho electrones más externos a su alrededor, quedándose con dos pares de electrones sin compartir| BH3 | CH4 | NH3 | H2O |
El Sodio y el Magnesio tienen las capas electrónicas 1 y 2 completas y uno y dos electrones, respectivamente, en el orbital s de la capa 3. Les resulta muy fácil ceder completamente un electrón (Sodio) o dos (Magnesio) a otro átomo que tenga facilidad para aceptarlos. El Sodio y el Magnesio forman enlaces cediendo electrones, NO compartiendo.
Por su lado, al Flúor le falta un electrón para tener la capa 2 completa.
Le resulta muy sencillo aceptar un electrón desde otro átomo que lo ceda fácilmente para conseguir la configuración del Neón.
El fluor forma enlaces aceptando electrones.