Concepto de Reacción Química
Aunque los átomos se unen entre sí formando moléculas que contienen enlaces químicos de gran estabilidad, éstos pueden romperse y/o reorganizarse.
De esta forma, a partir de unas moléculas, pueden formarse otras diferentes.
Si las moléculas no se transformaran unas en otras, el Universo no sería como lo conocemos y la vida no habría sido posible en él.
Al igual que les sucedía a los átomos, que formaban enlaces por medio de sus nubes electrónicas, las moléculas interaccionan entre sí y reaccionan combinando o modificando sus electrones más externos.
La densidad de las nubes electrónicas en una molécula no son uniformes y podremos encontrar zonas donde esa densidad es muy grande y otras donde es pequeña.
En general, una zona de densidad electrónica alta de una molécula tenderá a interaccionar primero y reaccionar después (compartirá densidad) con una zona de densidad baja de otra molécula y viceversa.
Para que exista una reacción química es necesario que se rompan y formen enlaces entre los átomos.
Romper un enlace implica un aporte de energía. Por contra, la formación de un enlace implica un desprendimiento de energía. Si en una reacción se desprende más energía al formar los enlaces que la necesaria para romperlos, el proceso será energéticamente favorable. Sin embargo esto no quiere decir que la reacción se produzca espontáneamente.
Las reacciones de oxidación de las moléculas biológicas de nuestro cuerpo con el oxígeno del aire, tan necesario, son muy favorables energéticamente. Afortunadamente, no se producen de manera espontánea y se dan muy lentamente. De otra forma, la vida no sería posible.
Por tanto, hay dos factores fundamentales para que una reacción química tenga lugar:
Balance de energía favorable entre los enlaces que se rompen y se forman.
Que las moléculas que reaccionan se encuentren y choquen en la orientación apropiada para que la reacción se produzca a una velocidad razonable.
Las moléculas han de chocar para producir una reacción. Si el choque es eficaz, la reacción se produce.
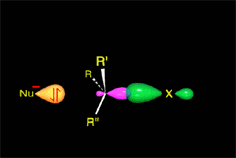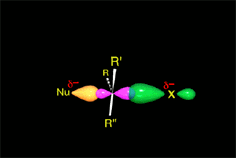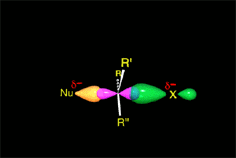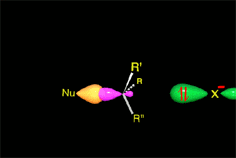
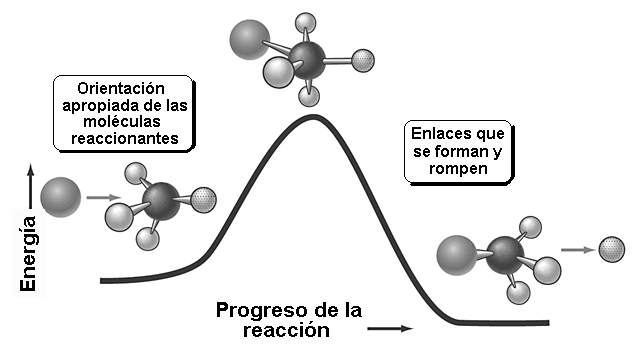 Hay un momento en que los enlaces que se forman y rompen están a medio formar o romper. Finalmente se llega a los productos.
Hay un momento en que los enlaces que se forman y rompen están a medio formar o romper. Finalmente se llega a los productos.
Un choque es eficaz si las moléculas se aproximan orientando sus regiones de densidad electrónica opuestas.

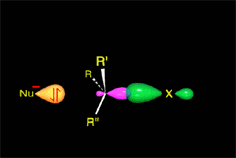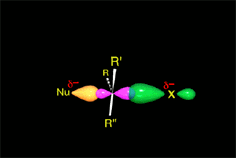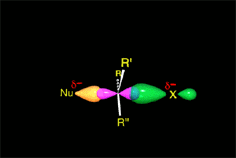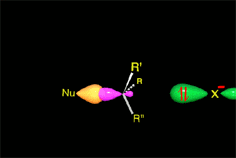
 Hay un momento en que los enlaces que se forman y rompen están a medio formar o romper. Finalmente se llega a los productos.
Hay un momento en que los enlaces que se forman y rompen están a medio formar o romper. Finalmente se llega a los productos.