En Química Orgánica, la química del carbono, el hidrógeno es también un átomo muy abundante. Por tanto, en las moléculas orgánicas hay numerosas funciones que poseen hidrógenos que pueden cederse como protones y que, por ello, muestran propiedades de ACIDEZ.
Lo primero que hay que considerar es cómo se debe romper un enlace para que una molécula sea capaz de ceder un protón (H+)
Ruptura HOMOLÍTICA:
Los dos electrones del enlace se reparten entre los dos átomos inicialmente enlazados. Esta ruptura es generalmente muy difícil y se da cuando el hidrógeno está unido a un átomo de electronegatividad baja o moderada.
Ruptura HETEROLÍTICA:
Los dos electrones del enlace se quedan del lado del átomo más electronegativo de los dos que forman el enlace. Esta es la forma más común de ruptura. Se da cuando el hidrógeno está unido a un átomo de electronegatividad alta.
Los grupos funcionales que poseen enlaces O-H pueden sufrir ruptura HETEROLÍTICA y muestran así propiedades ácidas más o menos fuertes. En algunos casos los enlaces C-H también pueden mostrar propiedades ácidas. Algunos ejemplos:
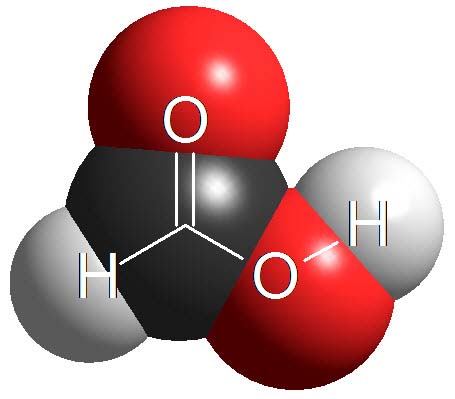 Ácidos carboxílicos
Ácidos carboxílicos
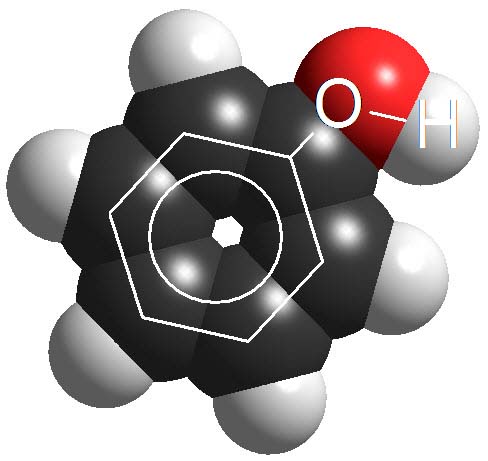 Fenoles
Fenoles
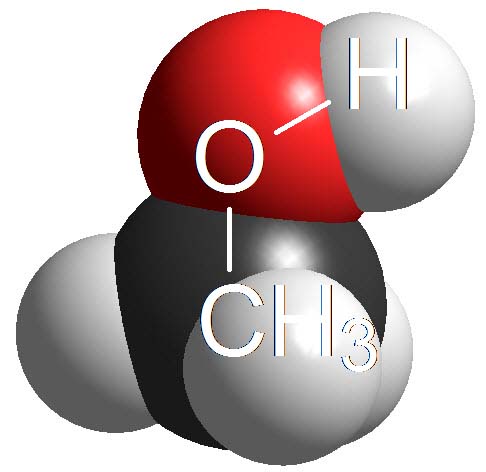 Alcoholes
Alcoholes
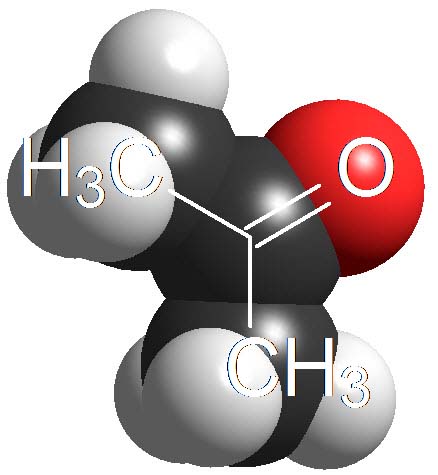 Cetonas
Cetonas
(C-H en alfa)
La frase "propiedades ácidas más o menos fuertes" no es muy científica. ¿Hay algún método para medir la acidez y darle un número?
El pKa es la medida numérica de la acidez y está relacionado con el desplazamiento del equilibrio ácido-base de un compuesto en agua.
¿Cuáles son los valores de pKa de los tipos de compuestos anteriores? En cada uno de ellos hay un cierto rango que depende de la estructura concreta. Al estudiar los grupos funcionales uno a uno, afinaremos más.
Los ácidos carboxílicos tienen el sobrenombre de "ácido". Sus valores de pKa están en el entorno de 1-5. Son los más ácidos de las cuatro clases.
Pero hay ácidos más fuertes, por supuesto. El ácido sulfúrico tiene un pKa = -3 (negativo). ¿Cuantas veces es más ácido el H2SO4 que el ácido acético (pKa = 4.9)? NO 8 veces ¡¡¡Casi 10 elevado a 8 veces!!! Recuerda el "logaritmo" en la definición de pKa.
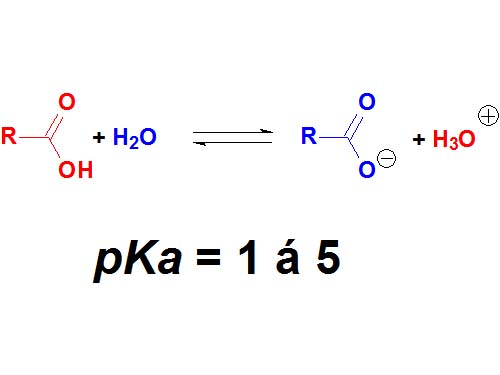 Ácidos carboxílicos
Ácidos carboxílicos
Los fenoles NO tienen el sobrenombre de "ácido". Sus valores de pKa están en el entorno de 7-10. Son débilmente ácidos.
¿Cuantas veces es menos ácido un fenol que un ácido carboxílico de media? NO 6 veces ¡¡¡Casi 10 elevado a 6 veces!!! Recuerda el "logaritmo" en la definición de pKa.
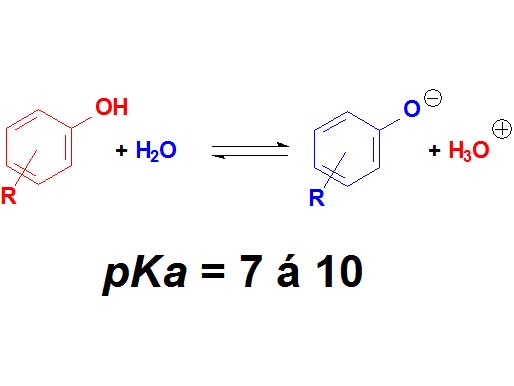 Fenoles
Fenoles
Los alcoholes NO tienen el sobrenombre de "ácido". Sus valores de pKa están en el entorno de 11-15. Son aún más débilmente ácidos que los fenoles. Fíjate en la diferencia que existe en el comportamiento de un grupo O-H de estar unido a un anillo aromático a un Csp3
¿Cuantas veces es menos ácido un alcohol que un fenol de media? NO 4 veces ¡¡¡Casi 10 elevado a 4 veces!!! Recuerda el "logaritmo" en la definición de pKa.
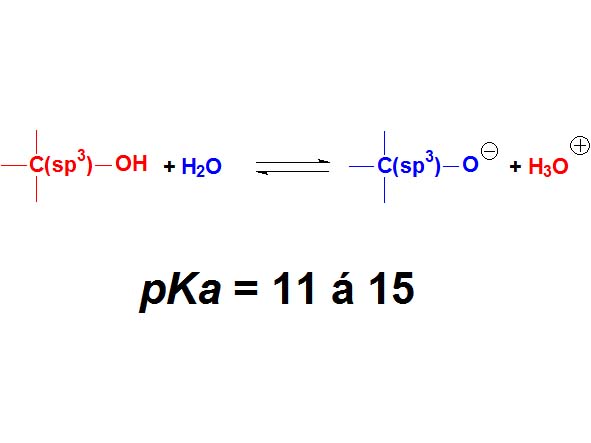 Alcoholes
Alcoholes
Los grupos C=O producen una acidez muy débil en el carbono contiguo. El valor de pKa de la acetona es 20. Son muy débilmente ácidos pero una base suficientemente fuerte puede extraer el protón en posición alfa al grupo C=O. Las cetonas no son ácidos de oxígeno sino de carbono. ¿Cuantas veces es menos ácida la acetona que un ácido carboxílico de media? NO 23 veces ¡¡¡Casi 10 elevado a 23 veces!!! Recuerda el "logaritmo" en la definición de pKa.
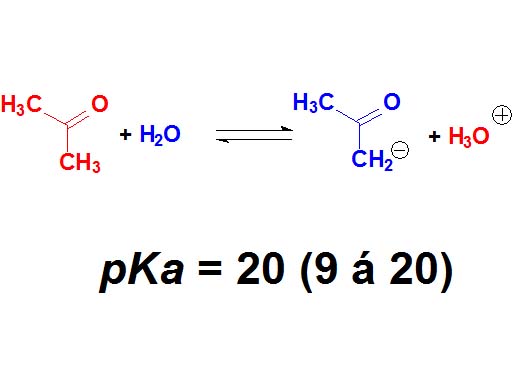 Cetonas
Cetonas
(C-H en alfa)
Cuanto más ácido es un compuesto, más desplazado tiene el equilibrio hacia la derecha.
Esto sugiere que un ácido será más ácido cuanto más estable sea su base conjugada, porque cuanto más estable sea esta última, más desplazado estará el equilibrio a la derecha.
El anión carboxilato es entonces la base conjugada más estable de las cuatro clases anteriores porque experimentalmente le corresponde el ácido más fuerte de todos.
Se puede describir mediante dos formas resonantes totalmente equivalentes, donde la carga negativa está deslocalizada por igual entre los dos oxígenos electronegativos. Esto sugiere que la deslocalización es sinónimo de estabilidad.
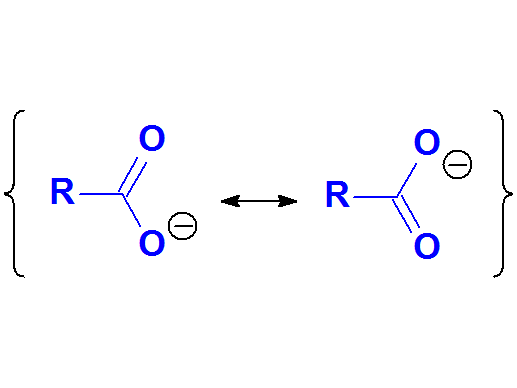 Anión Carboxilato
Anión Carboxilato
El anión fenóxido es una base conjugada menos estable que el carboxilato pero más que un alcóxido (alcoholes) porque así nos lo dice experimentalmente los valores de pKa.
Se puede describir mediante cuatro formas resonantes NO equivalentes. Ahora la carga negativa se deslocaliza hacia los carbonos del anillo, de menor electronegatividad que la de un oxígeno. La "calidad" de estas formas resonantes debe ser inferior a las del ion carboxilato.
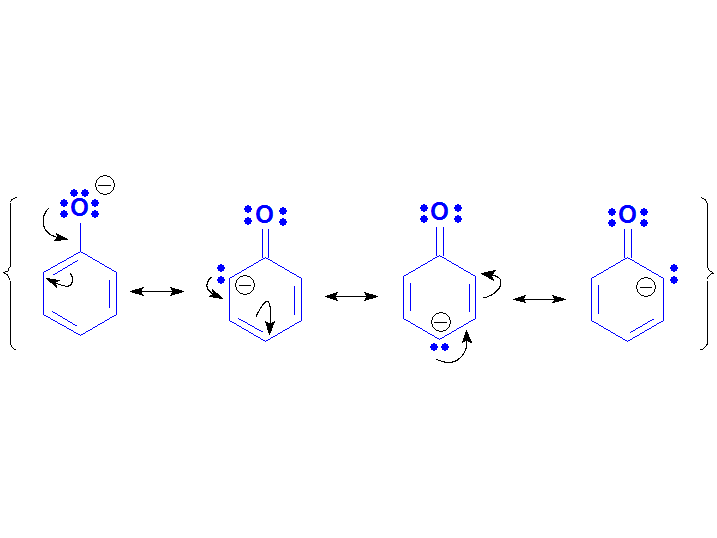 Anión Fenóxido
Anión Fenóxido
El anión alcóxido es una base conjugada aún menos estable que el fenóxido porque así nos lo dice experimentalmente los valores de pKa.
NO se puede describir mediante NINGUNA forma resonante porque no hay enlaces múltiples y/o pares de electrones sin compartir conjugados con el O-. Esto sugiere que la concentración de carga en un átomo es sinónimo de inestabilidad.
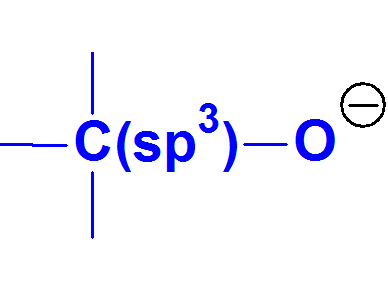 Anión Alcóxido
Anión Alcóxido
El anión enolato es la base conjugada menos estable de las del grupo porque así nos lo dice experimentalmente los valores de pKa.
Se puede describir mediante dos formas resonantes pero su "calidad" no debe ser muy buena. Esto sugiere que la concentración de carga negativa sobre un carbono es sinónimo de inestabilidad, incluso aunque parte de la carga se deslocalice hacia un oxígeno.
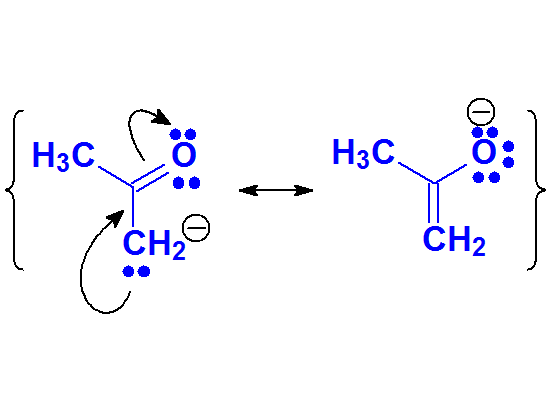 Anión Enolato
Anión Enolato
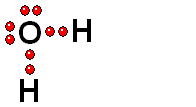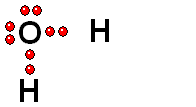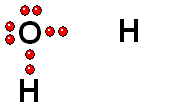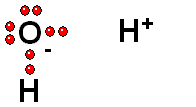
 Ácidos carboxílicos
Ácidos carboxílicos
 Fenoles
Fenoles
 Alcoholes
Alcoholes
 Cetonas
Cetonas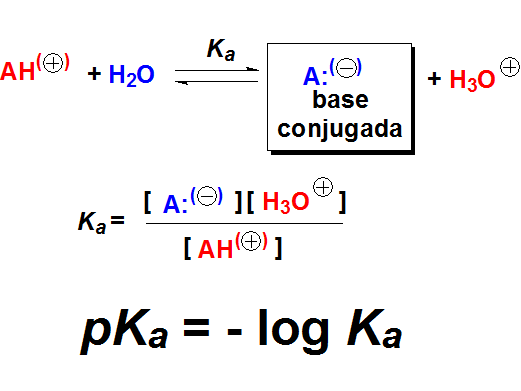
 Ácidos carboxílicos
Ácidos carboxílicos
 Fenoles
Fenoles
 Alcoholes
Alcoholes
 Cetonas
Cetonas Anión Carboxilato
Anión Carboxilato
 Anión Fenóxido
Anión Fenóxido
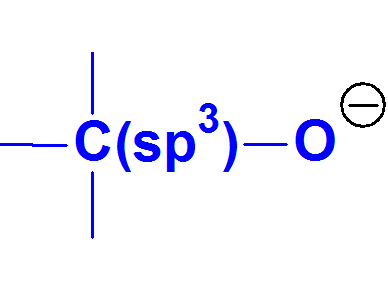 Anión Alcóxido
Anión Alcóxido
 Anión Enolato
Anión Enolato