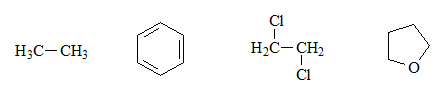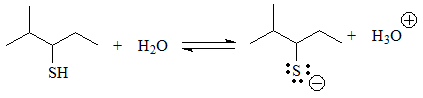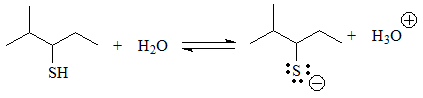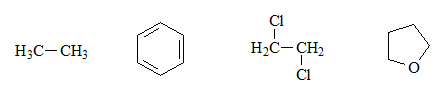Identifica los grupos ácidos en las siguientes moléculas y escribe los equilibrios esperados con agua, incluyendo las estructuras de las correspondientes bases conjugadas:
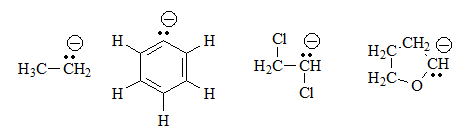
Estos cuatro compuestos no tienen ningún grupo ácido propiamente dicho, porque no hay ningún hidrógeno unido a un heteroátomo.
Por ello, el equilibrio con el agua no es posible.
Aunque el equilibrio con el agua no puede darse, podemos imaginar la estructura de las hipotéticas bases conjugadas como se indica, al perder un protón. Todas poseen un exceso de electrones sobre un carbono lo que es una situación de energía muy alta y, por tanto, muy desfavorable.
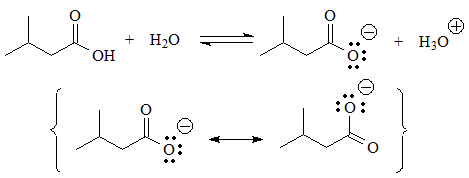
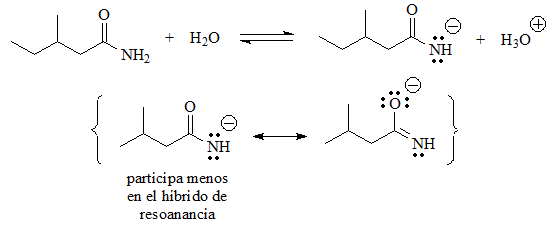
En estos casos sí existe una función ácida, porque hay hidrógenos unidos a heteroátomos.
Se puede establecer el equilibrio con el agua y la base conjugada posee una carga negativa sobre un heteroátomo más electronegativo que el carbono, lo que no es una situación tan sumamente desfavorable como las primeras. En algunos casos se puede deslocalizar la carga mediante resonancia, lo que aún estabiliza más la base conjugada.
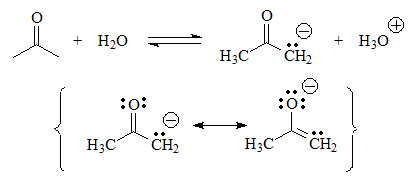
El caso de la acetona es especial. En realidad su acidez es muy baja, pero no tanto como la de los compuestos del primer grupo estudiado.
Aunque no hay hidrógenos unidos a heteroátomos y la base conjugada posee la carga negativa sobre un carbono, la acetona muestra cierta acidez y puede establecer el equilibrio con el agua.
La proximidad del grupo C=O hace que la carga se pueda repartir hacia el oxígeno. ¿Puedes escribir formas resonantes en la base conjugada que lo demuestren? Seguro que sí... Ahí las tienes ¡Inténtalo tú!
Ordena los compuestos anteriores por grupos de mayor a menor acidez
El más ácido de todos será el que posee el grupo COOH cuyo sobrenombre es precisamente el de "ácido" carboxílico.
La base conjugada es la MENOS INESTABLE de todas porque la carga se reparte entre los dos oxígenos por resonancia.
pKa = 4
El siguiente en acidez podría ser la amida, muy parecida en estructura al ácido carboxílico, salvo porque en vez de un grupo OH tiene un grupo NH2.
Pero la carga no se reparte entre átomos idénticos y por ello la base conjugada es mucho menos estable que el carboxilato.
pKa = 15 (las amidas son mucho menos ácidas de lo esperado)
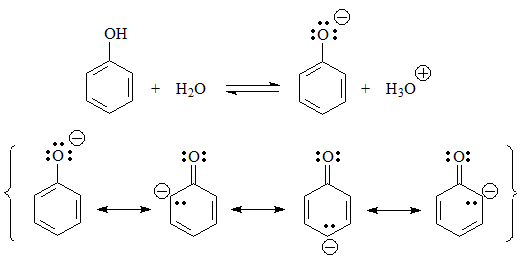
El siguiente grupo de ácidos son los fenoles, en los que la carga negativa de la base conjugada reside en un heteroátomo y se puede deslocalizar por el anillo aromático.
pKa = 10
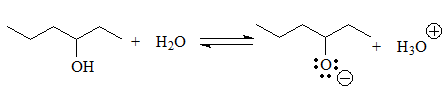
El siguiente grupo de ácidos son los alcoholes y tioles, en los que la carga negativa de la base conjugada reside en un heteroátomo pero no se puede deslocalizar porque el O ó S están unidos a carbonos sp3.
pKa = 13-15
El penúltimo ácido será la acetona. Aunque la carga negativa en la base conjugada se sitúa en un carbono, poco electronegativo, al lado está el grupo C=O con un sistema pi.
Esto permite una pequeña deslocalización de la densidad electrónica que estabiliza ligeramente la base conjugada.
pKa = 20
El último grupo de sustancias a colocar en este orden de acidez son aquellos que no tienen ningún hidrógeno unido a heteroátomo.
pKa > 30