En Química Orgánica, la química del carbono, los "heteroátomos" (elementos diferentes de carbono e hidrógeno) son muy abundantes y suelen tener pares de electrones sin compartir. Por tanto, en las moléculas orgánicas hay numerosas funciones que poseen electrones que pueden compartirse con protones y que, por ello, muestran propiedades de BASICIDAD.
Los grupos funcionales que poseen pares de electrones sin compartir pueden aceptar protones y comportarse como bases más o menos fuertes. Algunos ejemplos:
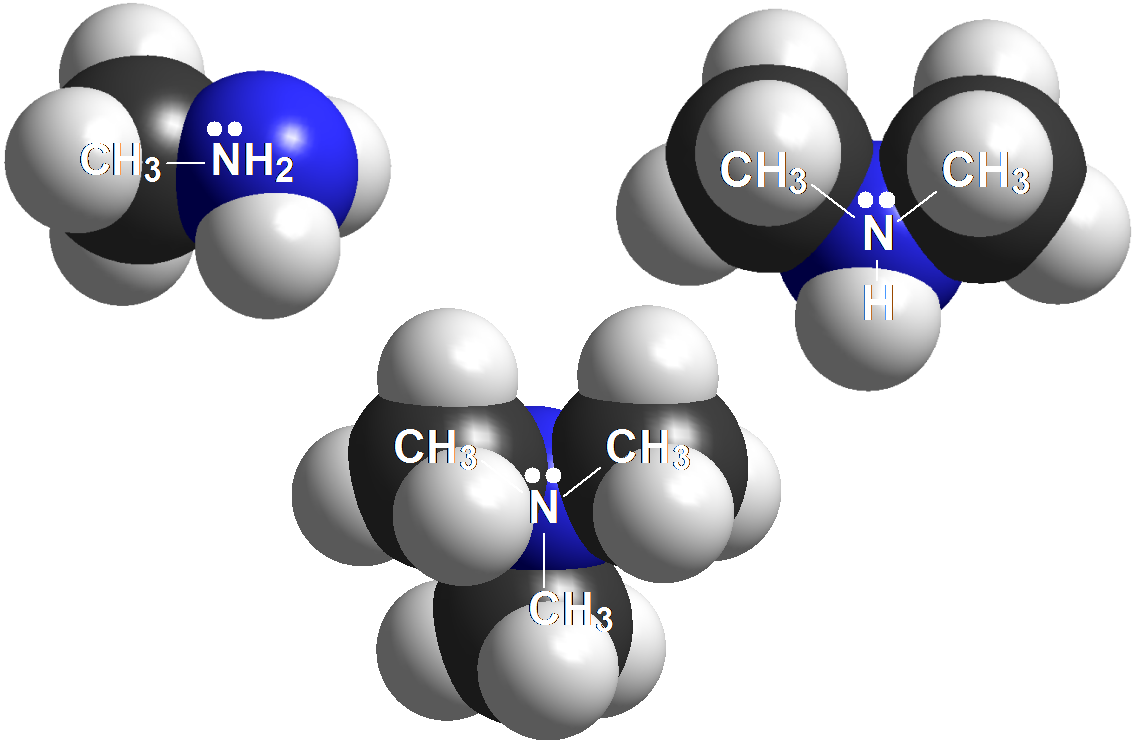 Aminas
Aminas
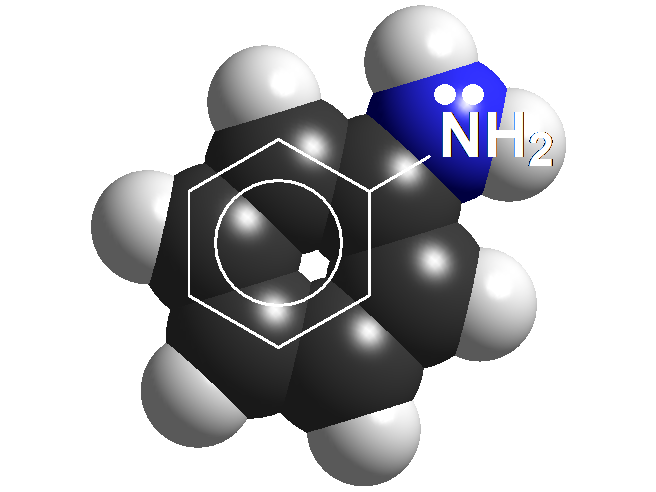 Anilinas
Anilinas
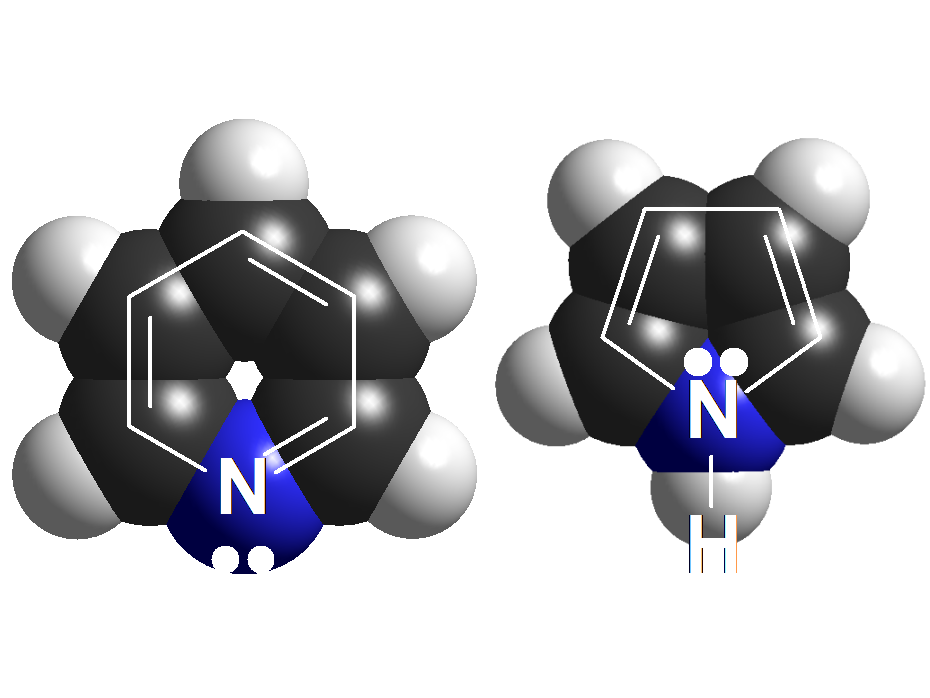 Piridina vs. Pirrol
Piridina vs. Pirrol
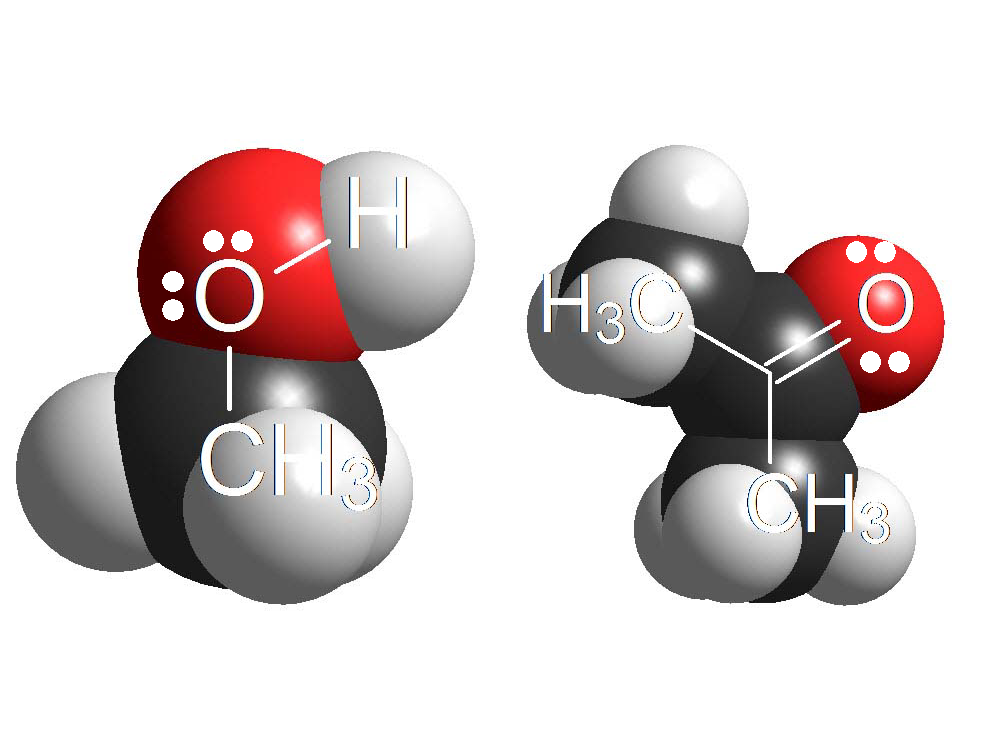 Alcoholes y Cetonas
Alcoholes y Cetonas
La frase "comportarse como bases más o menos fuertes" no es muy científica. ¿Hay algún método para medir la basicidad y darle un número?
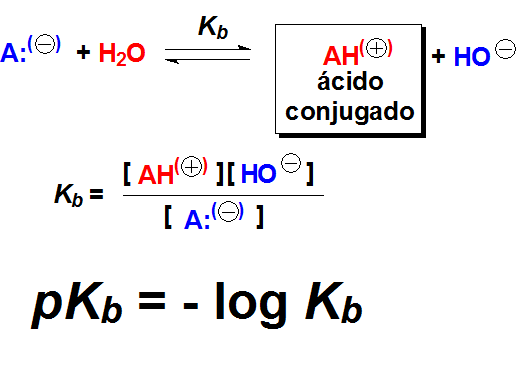
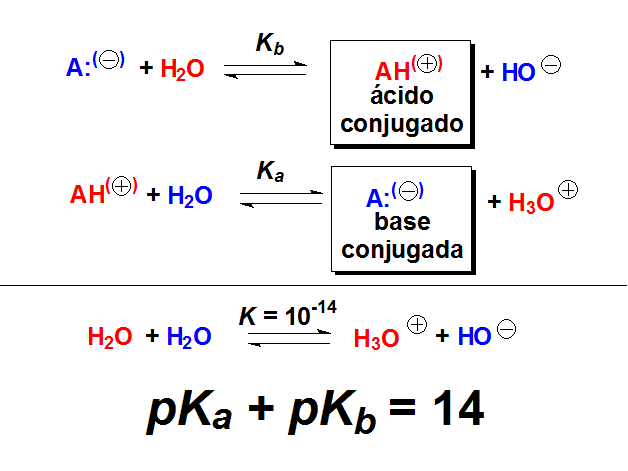
El pKb es la medida numérica de la basicidad y está relacionado con el desplazamiento del equilibrio ácido-base de un compuesto en agua.
El pKa y el pKb están relacionados por la constante de equilibrio del producto iónico del agua. Por tanto, a partir del pKa de un ácido podemos conocer el pKb de su base conjugada y viceversa.
¿Cuáles son los valores de pKb de los tipos de compuestos anteriores? En cada uno de ellos hay un cierto rango que depende de la estructura concreta. Al estudiar los grupos funcionales concretos, afinaremos más.
Las aminas son las bases más fuertes en Química Orgánica. Sus valores de pKb están en el entorno de 3-5. Sus ácidos conjugados, las sales de amonio, tienen una acidez comparable a la de un fenol. Esto es una coincidencia porque estructuralmente no tienen nada que ver.
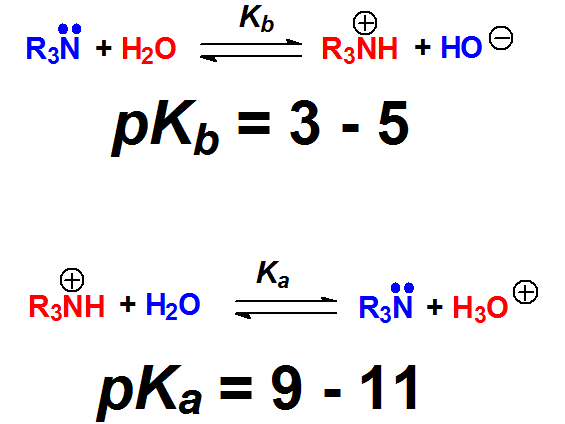 Aminas
Aminas
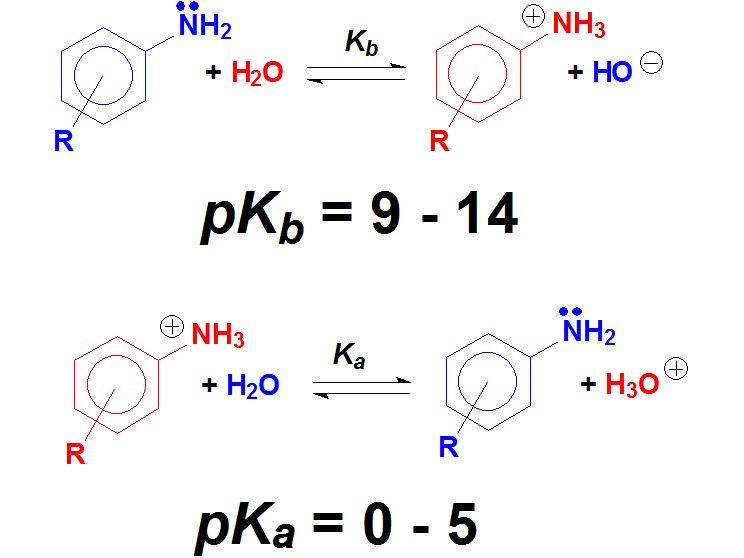 Anilinas
Anilinas
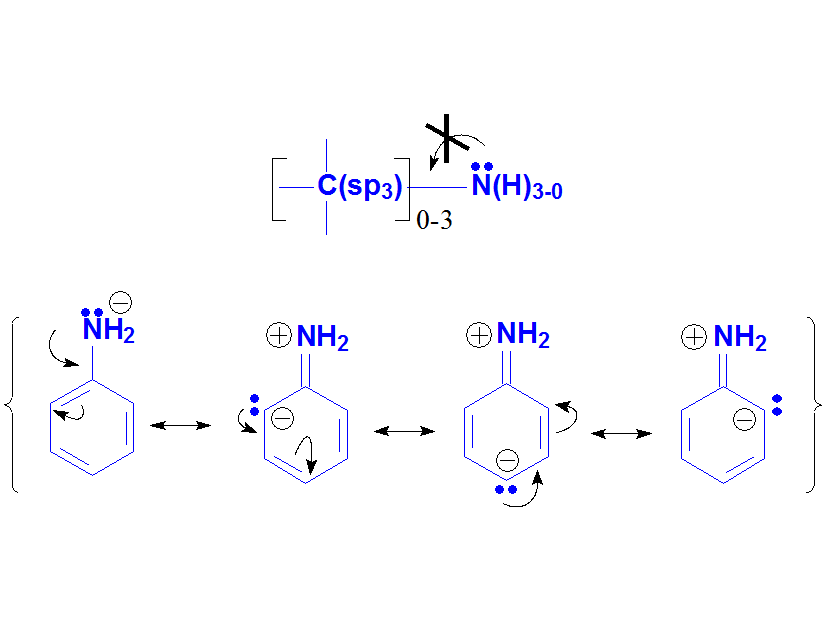
Las anilinas son casi iguales que las aminas salvo porque el N está unido al anillo aromático. Y eso debe hacer una gran diferencia porque la basicidad de las anilinas es mucho menor que la de las aminas. ¿Cuantas veces es menos básica una anilina que una amina de media? NO 6 veces ¡¡¡Casi 10 elevado a 6 veces!!! Recuerda el "logaritmo" en la definición de pKb. Los ácidos conjugados, las sales de anilinio, son tan ácidos como los ácidos carboxílicos.
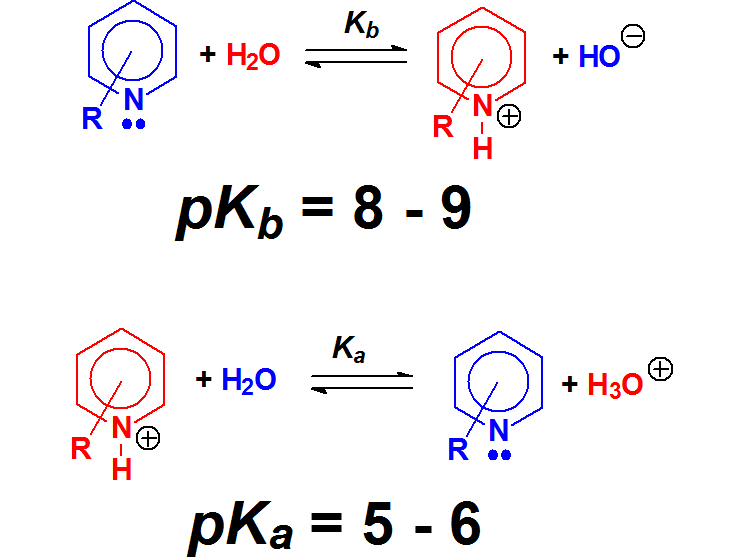
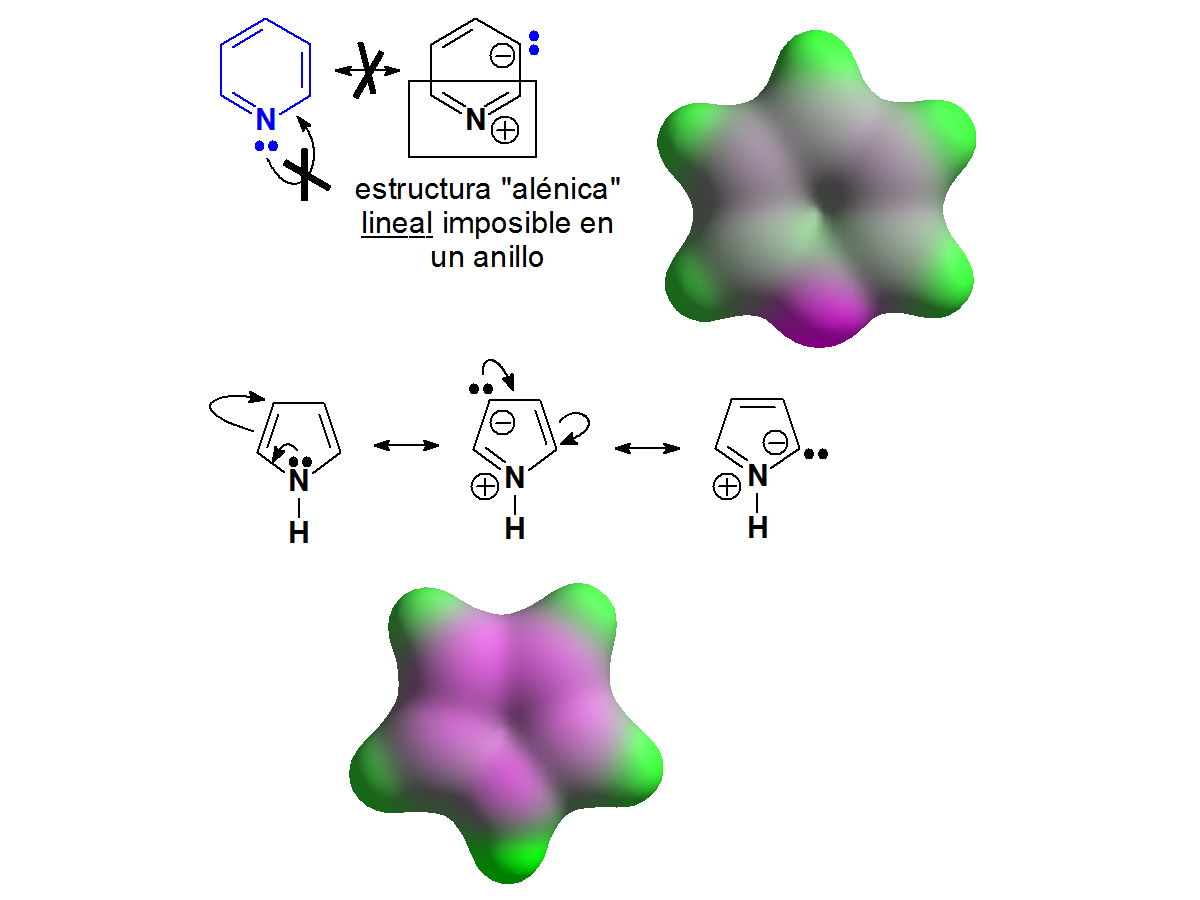
Las piridinas tienen una basicidad parecida a las anilinas. Sin embargo, el pirrol no es básico en absoluto. ¿Cuál es el misterio? Se resolverá cuando estudiemos la aromaticidad. Fíjate que la piridina y el benceno se parecen mucho. Hay tres dobles enlaces que implican 6 electrones (¡número mágico!) y el nitrógeno tiene proyectados sus electrones no compartidos hacia afuera. Sin embargo en el pirrol, para completar ese "número mágico" de 6 electrones, el nitrógeno tiene que ceder su par no compartido que no queda disponible hacia afuera.
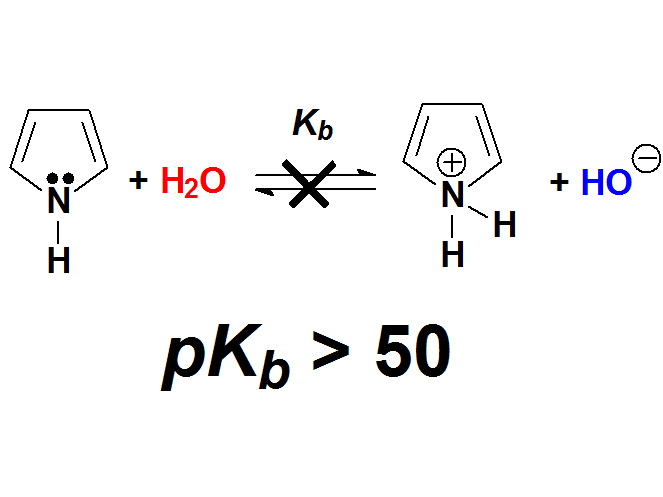 Anilinas vs. Pirroles
Anilinas vs. Pirroles
 Alcoholes y Cetonas
Alcoholes y Cetonas
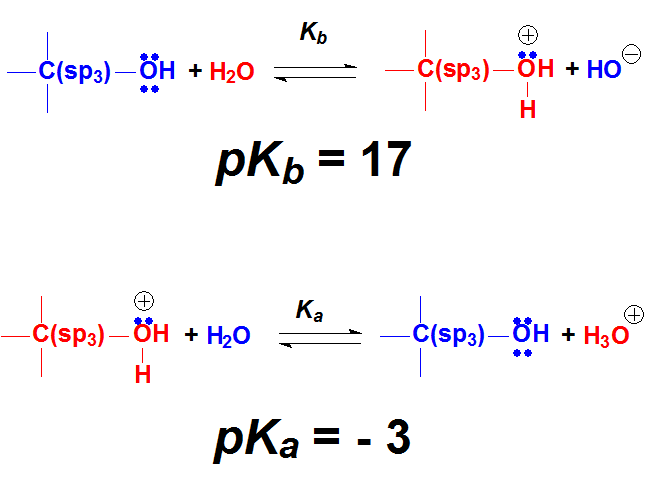
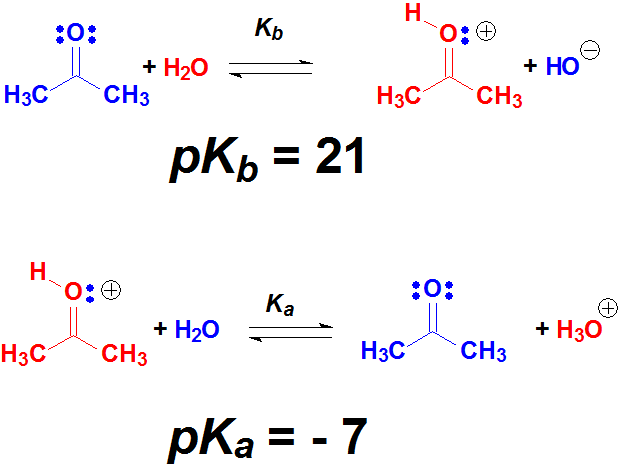
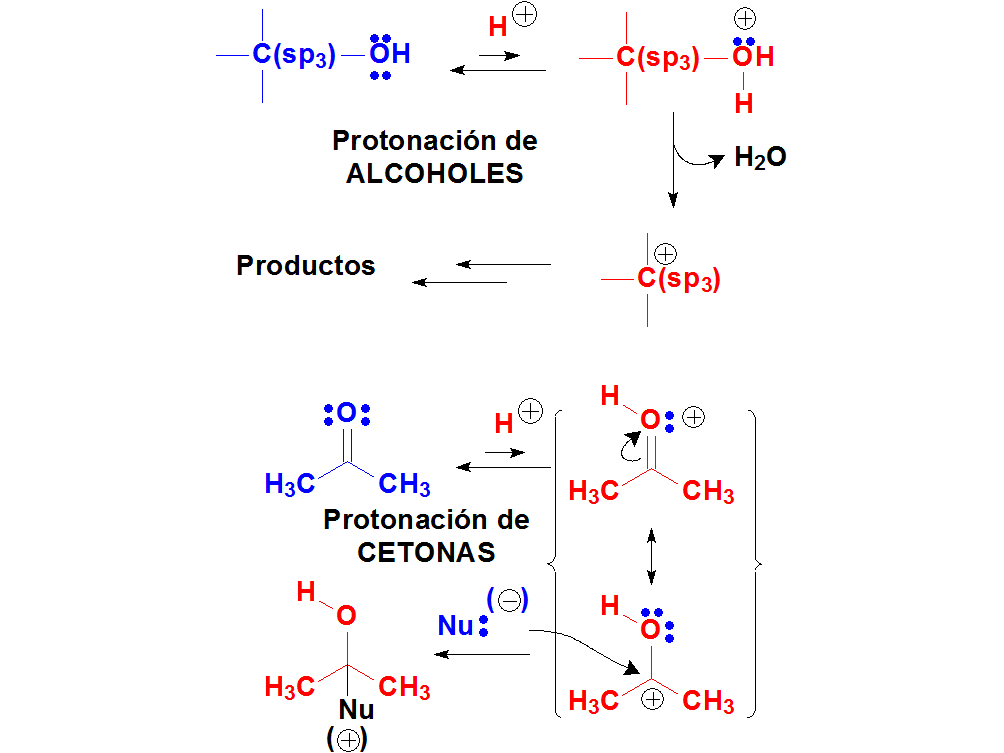
Los oxígenos tienen pares de electrones sin compartir y los protones de un ácido suficientemente fuerte pueden unirse a ellos. Cuando un grupo OH de un alcohol o el O=C se protonan, las moléculas protonadas son especies extraordinariamente reactivas.
El comienzo de numerosas reacciones de alcoholes y cetonas es la protonación con un ácido suficientemente fuerte.
Esto es algo que veremos con más detalle al describir los grupos funcionales correspondientes.
Cuanto más básico es un compuesto, más desplazado tiene el equilibrio hacia la derecha, lo que sugiere que la disponibilidad del par de electrones no compartido que pone en juego con el protón es mayor.
En las aminas el par electrónico está muy localizado en el nitrógeno, un átomo de electronegatividad no muy elevada. Por ello las aminas son las bases más fuertes de la Química Orgánica. Se protonan prácticamente al 100% con ácidos minerales.
Las anilinas tienen una basicidad menor que las aminas, lo que sugiere que el par de electrones no está tan disponible. Lo entendemos porque las anilinas se pueden describir con formas resonantes donde el par electrónico se deslocaliza hacia el anillo aromático.
 Aminas vs. Anilinas
Aminas vs. Anilinas
El nitrógeno de la piridina NO puede deslocalizar su par de electrones hacia los carbonos porque la estructura alénica lineal no es posible en un anillo. Por tanto, el par de electrones está disponible y las piridinas son compuestos básicos.
En el pirrol, por el contrario, el par de electrones se puede deslocalizar hacia el anillo y su disponibilidad es muy pequeña. Además, en el pirrol entra en juego el concepto de "aromaticidad" que comprenderás más adelante. Por ahora, las formas resonantes son suficientes para dar una explicación razonable al hecho experimental de que las piridinas son mucho más básicas que los pirroles.
 Piridina vs. Pirrol
Piridina vs. Pirrol
Los pares de electrones sobre un oxígeno de alcohol o cetona son débilmente básicos porque están sobre un átomo muy electronegativo. Pero con un ácido suficientemente fuerte se pueden protonar, al menos un cierto % de las moléculas. Estas moléculas protonadas son muy reactivas y pueden dar lugar a productos nuevos. En muchas ocasiones, el primer paso de la reacción de un alcohol o cetona es su protonación.
 Alcoholes vs. Cetonas
Alcoholes vs. Cetonas
 Aminas
Aminas
 Anilinas
Anilinas
 Piridina vs. Pirrol
Piridina vs. Pirrol
 Alcoholes y Cetonas
Alcoholes y Cetonas
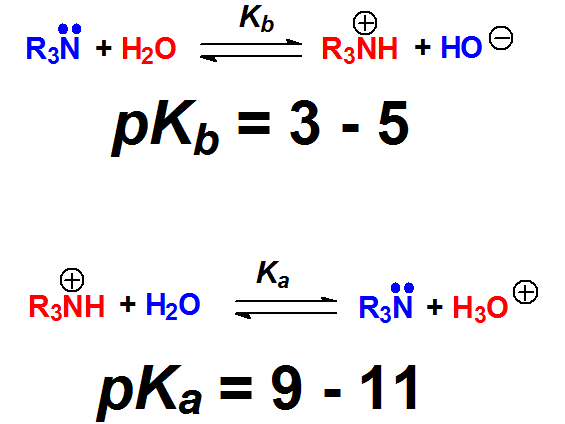 Aminas
Aminas
 Anilinas
Anilinas

 Anilinas vs. Pirroles
Anilinas vs. Pirroles

 Alcoholes y Cetonas
Alcoholes y Cetonas Aminas vs. Anilinas
Aminas vs. Anilinas
 Piridina vs. Pirrol
Piridina vs. Pirrol
 Alcoholes vs. Cetonas
Alcoholes vs. Cetonas