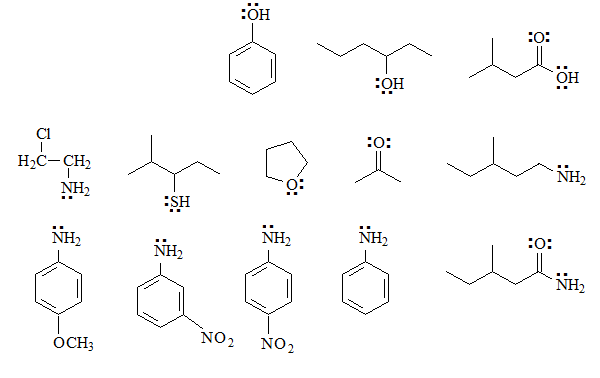
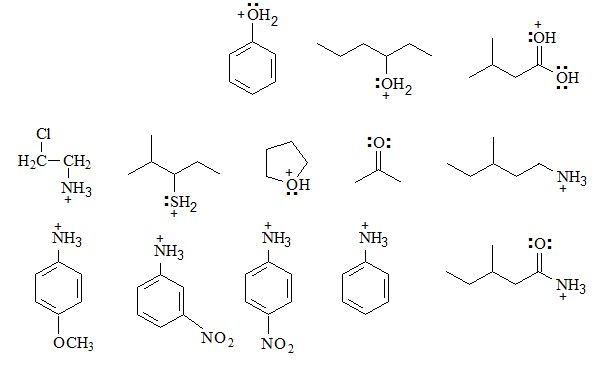
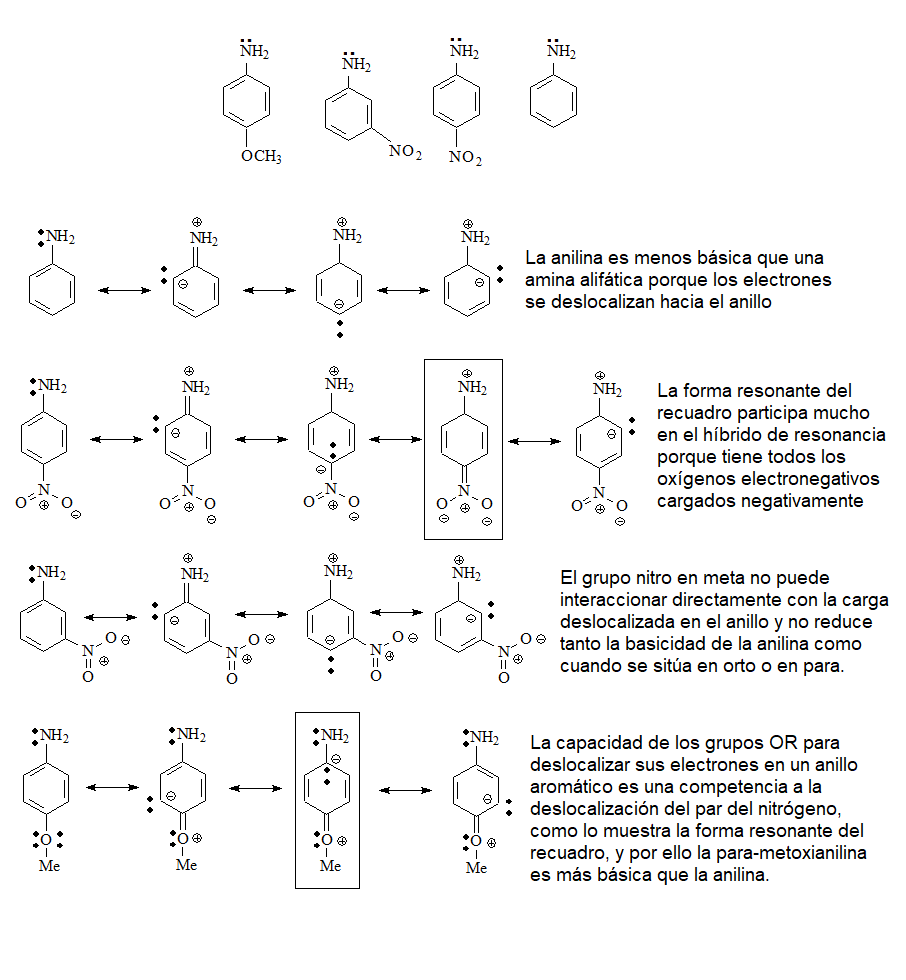
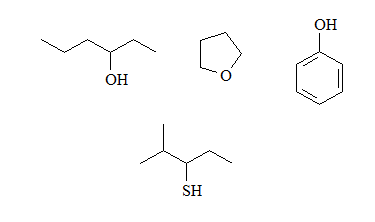
Identifica los grupos básicos en las siguientes moléculas y escribe los equilibrios esperados con agua, incluyendo las estructuras de los correspondientes ácidos conjugados:
Estos dos compuestos no tienen ningún grupo básico propiamente dicho, porque no hay ningún átomo con pares de electrones libres que poder ceder.
Por ello, el equilibrio con el agua no es posible.
En estos casos sí existe al menos una función básica, porque hay heteroátomos con electrones sin compartir.
Se puede establecer el equilibrio con el agua y el ácido conjugado posee una carga positiva sobre un heteroátomo más electronegativo que el carbono, lo que no es una situación sumamente favorable. Por ello el equilibrio está muy desplazado hacia la base.
A pesar de ello podemos estudiar la basicidad relativa a partir de las formas resonantes de la base, si es posible escribir alguna.
En el ácido conjugado cargado positivamente no se pueden escribir formas resonantes porque el heteroátomo quedaría rodeado de 10 electrones.
Cuanto más deslocalizados estén los electrones en la base de partida por resonancia, menos disponibles estarán hacia el agua (que actúa de ácido) y menor será su fortaleza básica.
Ordena los compuestos anteriores por grupos de mayor a menor basicidad
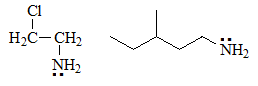
Las más básicas serán las aminas alifáticas en las que el par de electrones sin compartir del nitrógeno no puede deslocalizarse por resonancia al estar unidos los nitrógenos a carbonos sp3.
pKb = 3-5
Cabe esperar que la 2-cloroetilamina sea un poco menos básica por el efecto inductivo atractor del Cl (electronegatividad) que retira densidad electrónica del nitrógeno.
Las siguientes en basicidad serán las ANILINAS (pKb = 9-14) en las que el par de electrones del nitrógeno está menos disponible que en las anteriores por efecto de la resonancia con el anillo. Los grupos atractores de electrones en orto o para (efecto mesómero -M) todavía reducen más la basicidad. Es el caso de la para-nitroanilina. Los grupos dadores de electrones (efecto mesómero +M), como el grupo OMe, aumenta la basicidad porque disminuyen la deslocalización del par electrónico del nitrógeno.
Los alcoholes y éteres tienen una pequeña basicidad porque el átomo de oxígeno es muy electronegativo y cede sus electrones con menos facilidad que un nitrógeno.
Los fenoles serán menos básicos que los alcoholes porque la desnsidad electrónica del oxígeno se puede deslocalizar hacia el anillo.
Los tioles serán más básicos que los alcoholes porque el azufre es menos electronegativo que el oxígeno.
pKb = 15-17
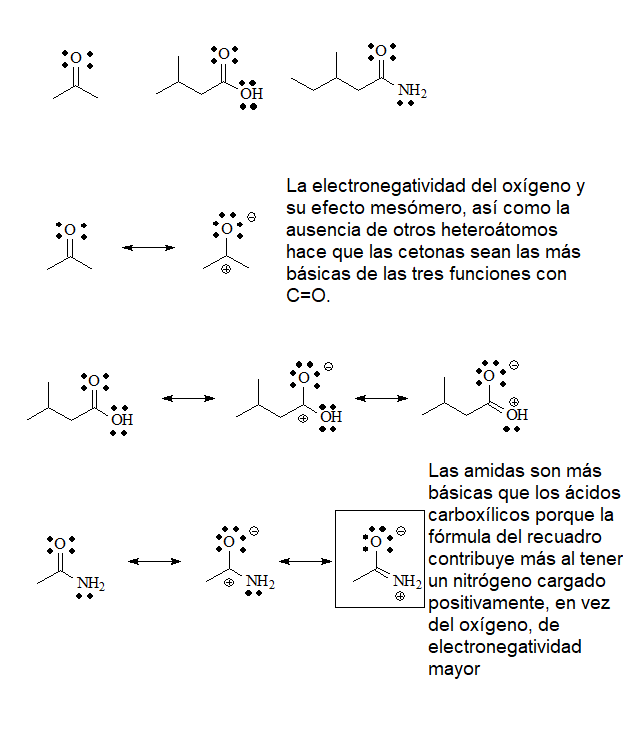
El último grupo de bases serán las que poseen el grupo C=O. En él los electrones no compartidos del oxígeno residen en orbitales sp2, con un mayor carácter s y más cercanos al núcleo por lo que estarán menos disponibles hacia un ácido exterior. De todas formas, la protonación de un grupo C=O por un ácido suficientemente fuerte es muy importante para aumentar su reactividad.
pKb = 21