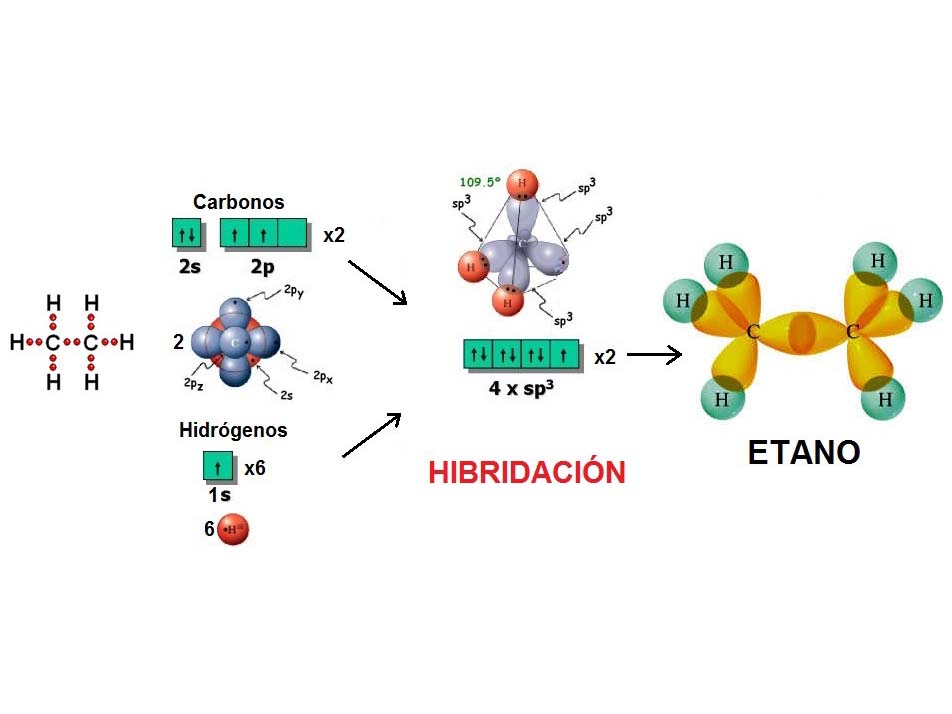
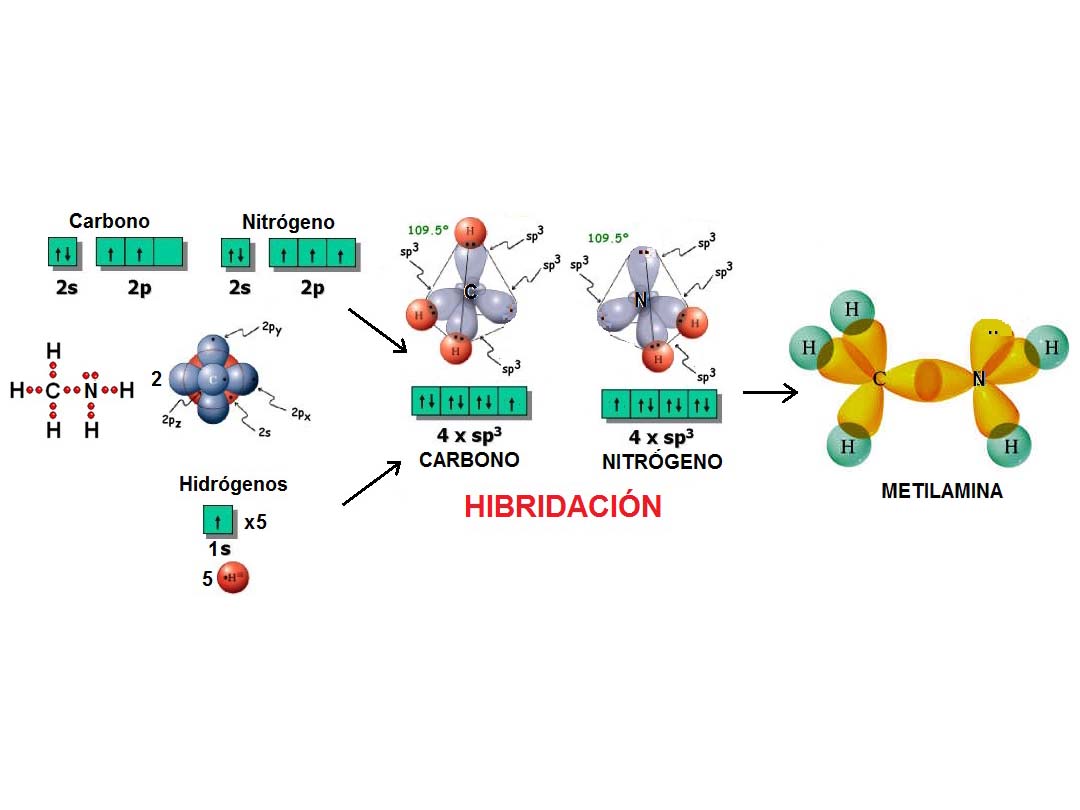
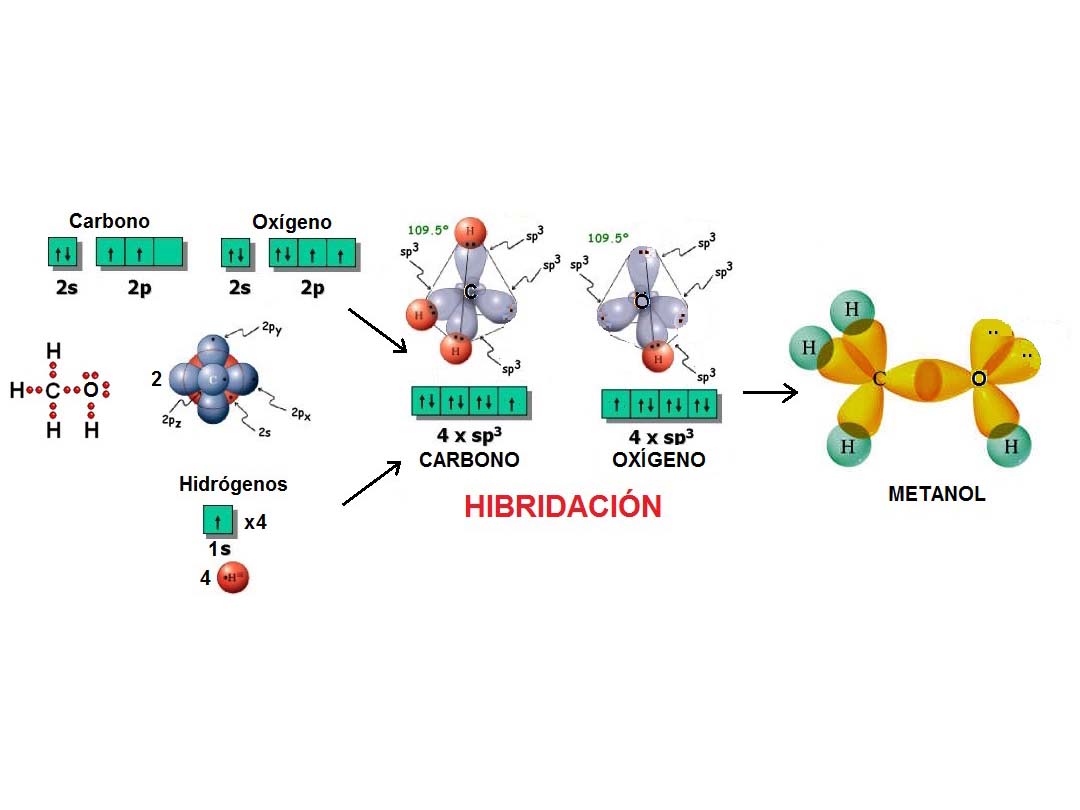
Al igual que cuatro globos se disponen formando un TETRAEDRO, cuatro densidades electrónicas adoptan esa forma para estar lo más alejadas unas de otras y minimizar la repulsión.

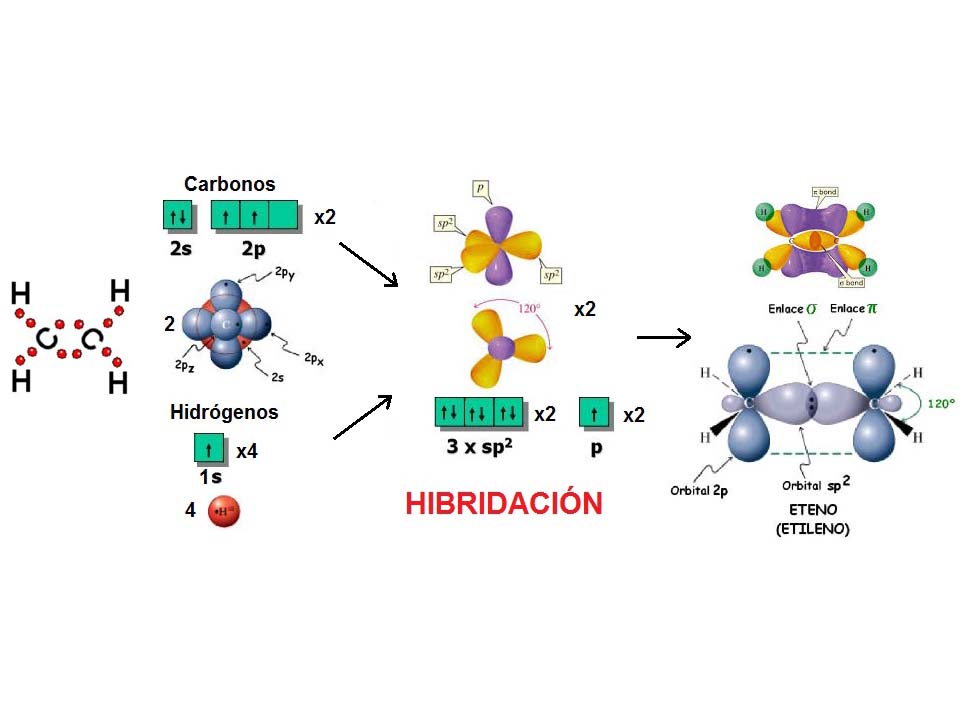
Al igual que tres globos se disponen de forma TRIGONAL PLANA, tres densidades electrónicas adoptan esa forma para estar lo más alejadas unas de otras y minimizar la repulsión.

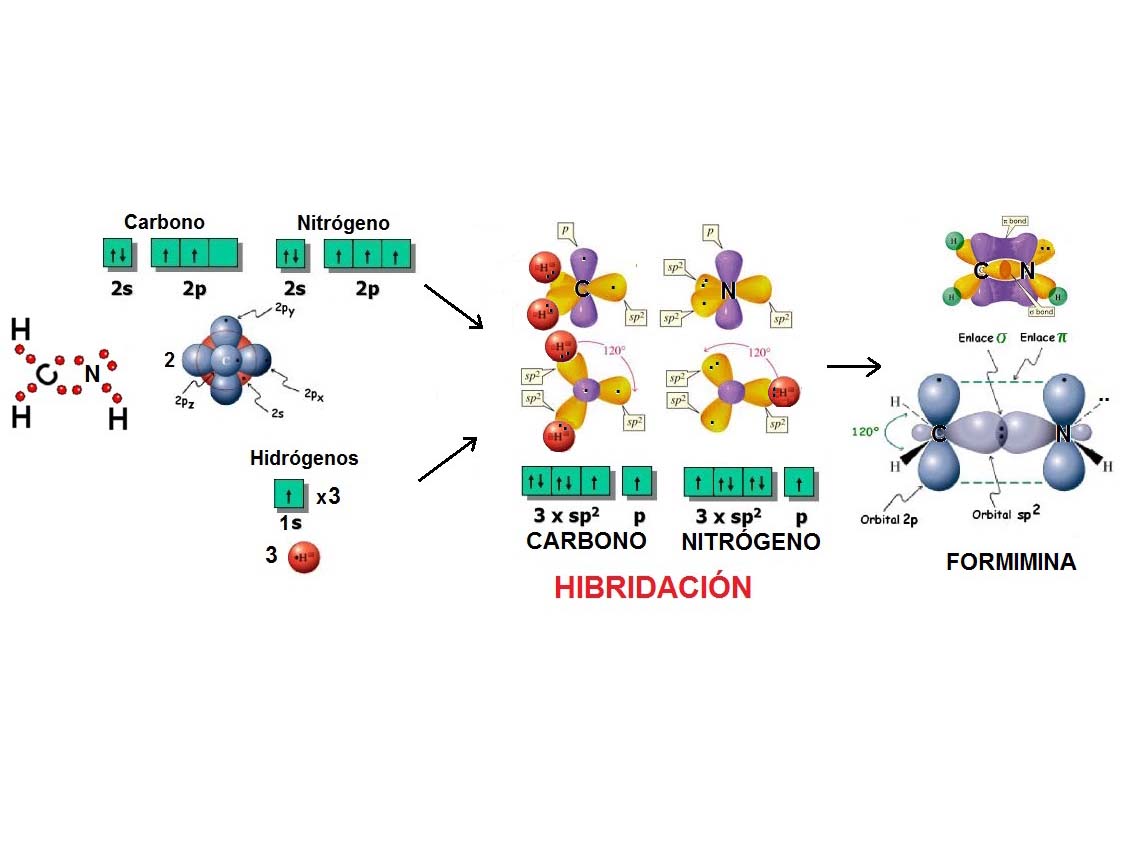
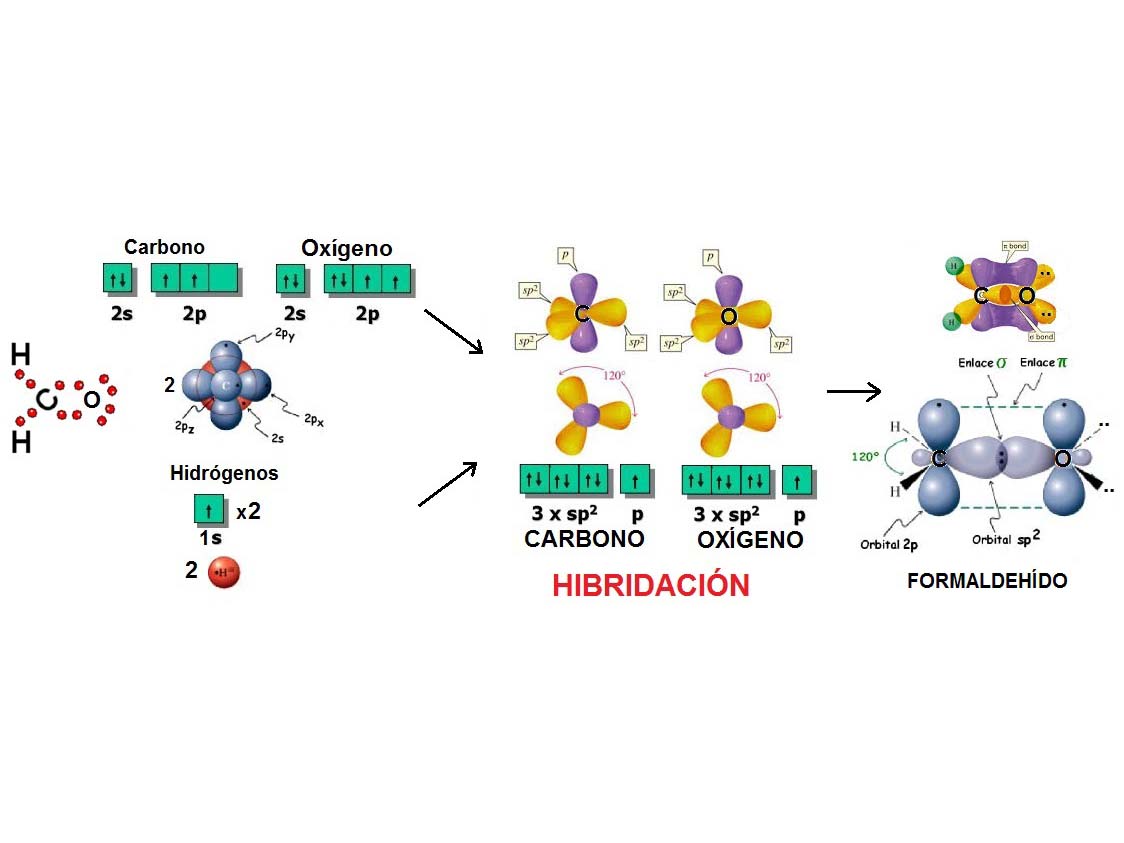
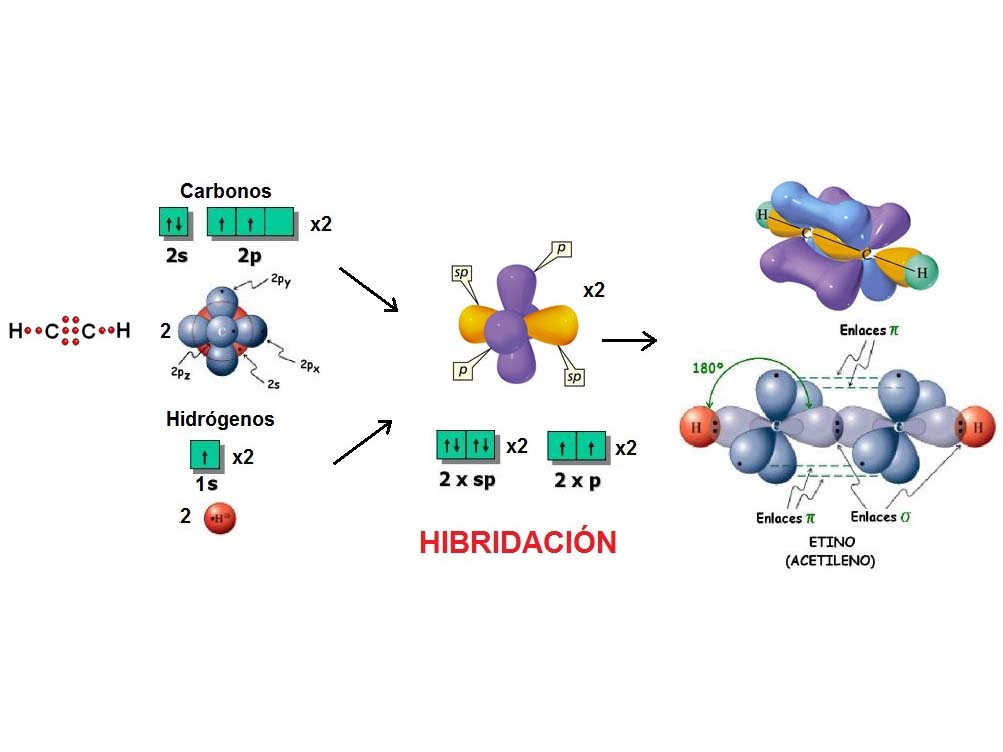
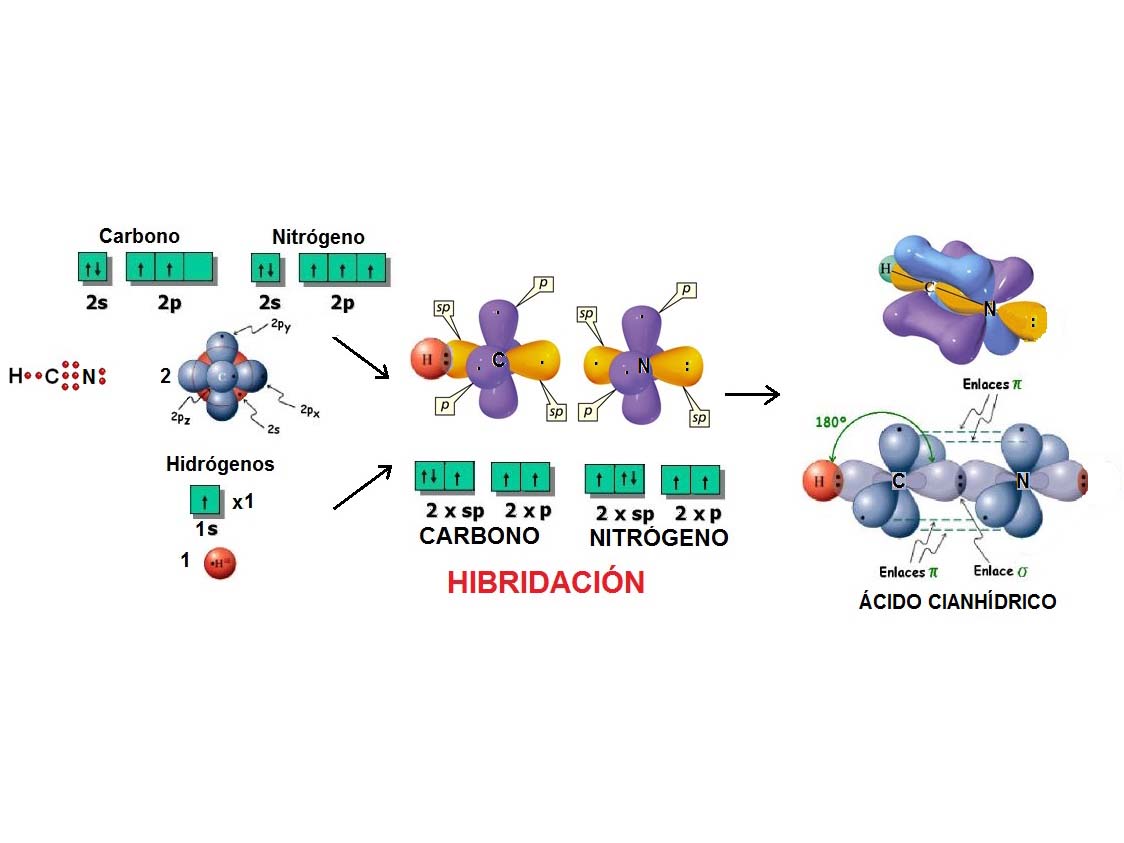
Al igual que dos globos se disponen de forma LINEAL, dos densidades electrónicas adoptan esa forma para estar lo más alejadas unas de otras y minimizar la repulsión.