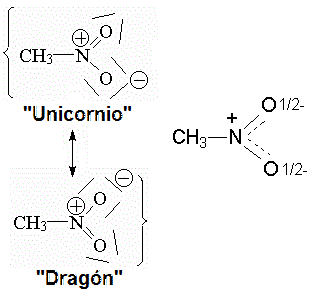
¿Cómo explicarías a alguien que no ha visto ninguno, cómo es un rinoceronte? Utilizarías símiles. Por ejemplo, podrías explicar que un rinoceronte real es algo, digamos intermedio, entre un unicornio y un dragón. La explicación puede ser más o menos afortunada pero si la persona con la que hablas conoce qué son los unicornios y los dragones, se hará una idea bastante razonable de lo que es en realidad un rinoceronte.
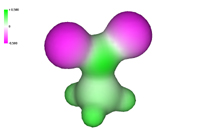
La realidad de la molécula de nitrometano ("rinoceronte") es que los dos enlaces N-O son totalmente equivalentes en todas sus propiedades: fortaleza, distancia N-O, etc.
Sin embargo, la fórmula de Lewis sugiere que un enlace es N-O y el otro es N=O. Necesitamos explicar la realidad con "unicornios" y "dragones" apropiados.
Molécula real de nitrometano con los dos enalces N-O equivalentes 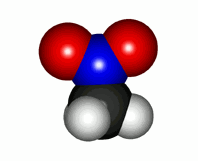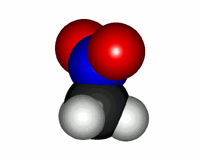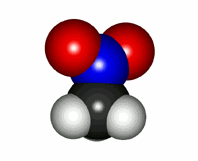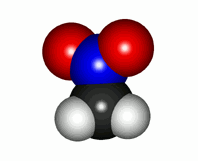
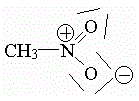 Con esta estructura de Lewis únicamente no se puede explicar la realidad del nitrometano
Con esta estructura de Lewis únicamente no se puede explicar la realidad del nitrometano
En este caso el "unicornio" y el "dragón" son casi iguales. El nitrometano se tiene que describir con dos formas de Lewis muy parecidas, en las que solo varía cual de los dos oxígenos sustenta el doble enlace con el nitrógeno. En muchos casos se puede dibujar una fórmula "intermedia" para describir la "resonancia" del nitrometano entre las dos fórmulas de Lewis
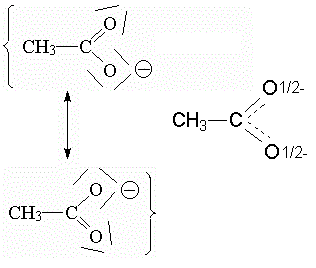
En el ion acetato sucede algo semejante. Los dos enlaces C-O son en la realidad equivalentes. Pero en la fórmulas de Lewis uno es C-O y el otro C=O. El ion acetato "resuena" entre las dos fórmulas de Lewis. En este caso también se puede dibujar una fórmula intermedia.
1. Las estructuras resonantes sólo suponen movimiento de electrones (NUNCA de átomos) desde posiciones adyacentes.
2. Las estructuras resonantes en la que todos los átomos del 2º período poseen octetes completos son más importantes (contribuyen más al híbrido de resonancia) que las estructuras que tienen los octetes incompletos.
3. Las estructuras más importantes son aquellas que supongan la mínima separación de carga.
4. En los casos en que una estructura de Lewis con octetes completos no puede representarse sin separación de cargas, la estructura más importante será aquella en la que la carga negativa se sitúa sobre el átomo más electronegativo y la carga positiva en el más electropositivo.
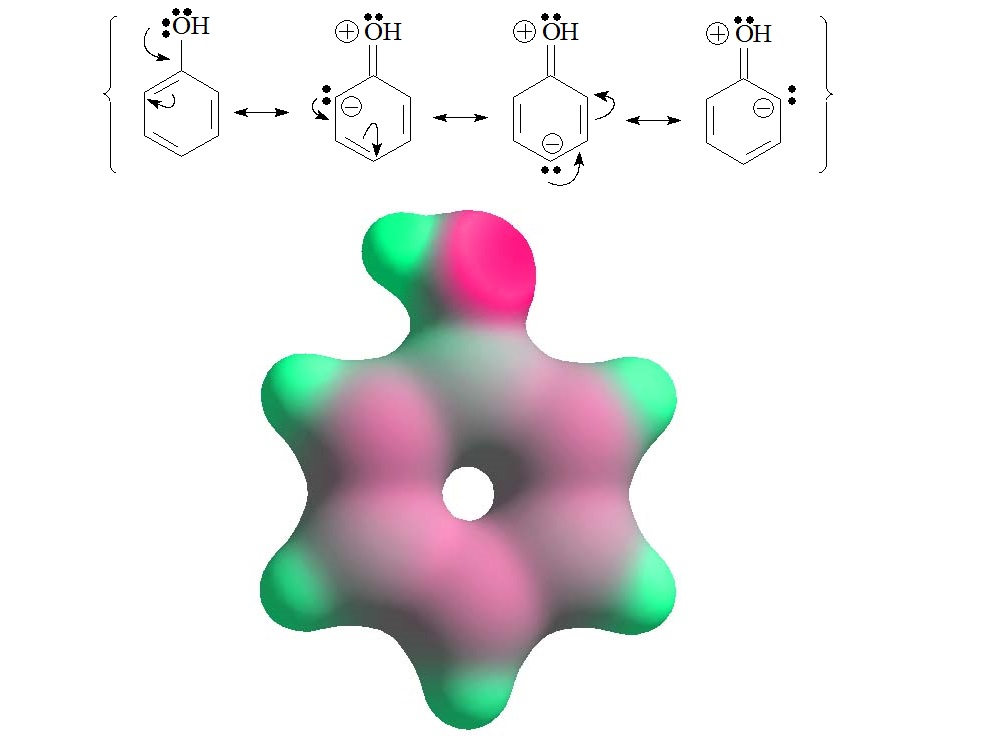
La realidad del fenol es que el anillo aromático tiene un ligero exceso de carga en las posiciones "orto" y "para" al grupo OH. Se necesitan cuatro fórmulas de Lewis para explicarlo.
La forma predominante es la primera, que no tiene separación de cargas. Las otras, a pesar de que sitúan la carga positiva sobre el átomo más electronegativo, son las únicas que explican por qué el anillo tiene un ligero exceso de densidad electrónica en las posiciones "orto" y "para"
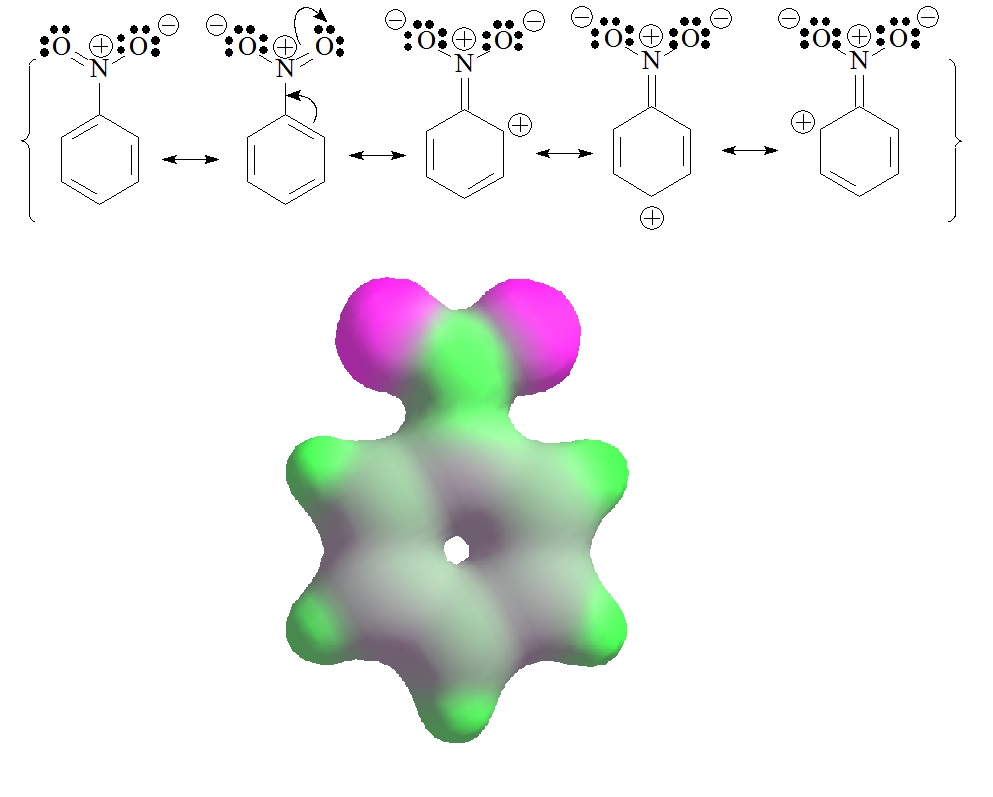
La realidad del nitrobenceno es la contraria: el anillo aromático tiene un ligero defecto de carga en las posiciones "orto" y "para" al grupo nitro. Se necesitan cinco fórmulas de Lewis para explicarlo.
La forma predominante son las dos primeras, que tienen la separación de cargas "normal" debida a la estructura del grupo nitro. Las otras, a pesar de que aumentan la separación de cargas, son las únicas que explican por qué el anillo tiene un ligero defecto de densidad electrónica en las posiciones "orto" y "para"


 Con esta estructura de Lewis únicamente no se puede explicar la realidad del nitrometano
Con esta estructura de Lewis únicamente no se puede explicar la realidad del nitrometano