PROPIEDADES ÁCIDO-BASE DE ANHÍDRIDOS
Basicidad del Grupo Carbonilo
La basicidad de un grupo carbonilo puede estudiarse a partir de la acidez de su forma protonada. Cuanto más ácida la forma protonada, menos básico será el grupo carbonilo de partida.
La forma protonada de un grupo carbonilo será más estable (menos ácida) cuanto más participe la tercera forma resonante. Por tanto, un grupo carbonilo será más básico cuanto más capacidad de dar electrones tenga el grupo L.
¿Puedes explicar los valores de pKa de los siguientes grupos carbonilo protonados, utilizando el razonamiento anterior?
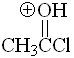 Cloruro de acetilo
Cloruro de acetilo
pKa = -9.0
Un átomo de cloro es muy electronegativo y hace que la forma protonada de un cloruro de ácido (acilo) sea excepcionalmente inestable. Los cloruros de ácido poseen los grupos carbonilo menos básicos de toda la serie estudiada.
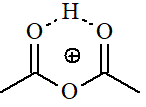 Anhídrido
Anhídrido
acético
pKa = -8.5
La electronegatividad del grupo O-C=O debe ser muy semejante a la de un átomo de Cl. Pero la probabilidad de que el carbonilo se protone es doble. Además, el protón de la especie protonada puede establecer un enlace de hidrógeno con ambos carbonilos. Esto explica que los anhídridos sean ligeramente más básicos que los cloruros de ácido.
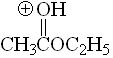 Éster
Éster
pKa = -6.5
El grupo alcoxilo puede estabilizar la carga positiva por efecto mesómero. Por ello los ésteres son más básicos que las cetonas.
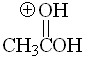 Ácido
Ácido
pKa = -6.0
La primera y tercera formas resonantes son equivalentes en un ácido protonado. Eso le da una estabilidad adicional que hace que paradójicamente un ácido sea el más básico de esta serie.
Acidez de los Hidrógenos en alfa
Los hidrógenos en alfa a un grupo carbonilo resultan débilmente ácidos, debido a su estabilización del anión resultante por deslocalización.
¿Qué influencia tiene el grupo L?
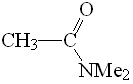 DMF
DMF
pKa = 30
Las amidas tienen los hidrógenos en alfa menos ácidos a causa del efecto fuertemente dador de electrones del grupo NMe2 que inestabiliza la forma aniónica.
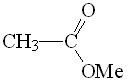 Acetato de metilo
Acetato de metilo
pKa = 25
La mayor electronegatividad del grupo OMe permite explicar la mayor acidez de los hidrógenos en alfa de un éster respecto de una amida.
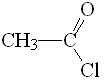 Cloruro de acetilo
Cloruro de acetilo
pKa = 16
Uno de los compuestos el que tiene los hidrógenos más ácidos es el cloruro de ácido (pKa menor), que es el que tiene el grupo L más electronegativo. Cuanto más electronegativo es L más estabilizado está el anión y más ácidos resultan los hidrógenos en alfa.
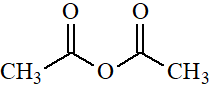 Anhídrido acético
Anhídrido acético
pKa = 16
Los anhídridos se comportan de manera muy semejante a los cloruros de ácido porque la electronegatividad del Cl y del grupo O-CO son muy semejantes.
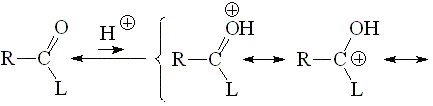
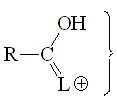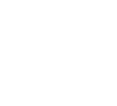
 Anhídrido
Anhídrido Anhídrido acético
Anhídrido acético