PROPIEDADES ÁCIDO-BASE DE NITRILOS
La basicidad del grupo nitrilo puede estudiarse a partir de la acidez de su forma protonada.
La forma protonada de un grupo nitrilo es extremadamente ácida lo que indica que el nitrógeno es extraordinariamente menos básico que el de una anilina y/o amina.
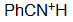 Benzo-nitrilo
Benzo-nitrilo
pKa = -10.0
El par de electrones del nitrógeno de un nitrilo reside muy cerca del núcleo en un orbital sp y eso le hace ser muy inaccesible.
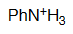 Anilina
Anilina
pKa = 4.6
El par de electrones del nitrógeno de la anilina está parcialmente deslocalizado hacia el anillo lo que hace que una anilina sea menos básica que una amina, o un catión anilinio más ácido que un amonio.
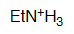 Etilamina
Etilamina
pKa = 10.6
El par de electrones del nitrógeno de una amina está plenamente localizado y por ello son las más básicas.
Acidez de los Hidrógenos en alfa
Los hidrógenos en alfa a un nitrilo resultan muy débilmente ácidos, indicando que la estabilización del anión resultante que provoca el grupo CN es más débil que la de un grupo carbonilo.
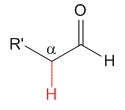 Aldehído
Aldehído
pKa = 17
El hidrógeno no ejerce ningún efecto especial y podemos tomar el valor de pKa = 17 como referencia de acidez de hidrógenos en alfa a un grupo carbonilo.
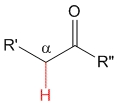 Cetona
Cetona
pKa = 20
El grupo metilo es dador de electrones por efecto inductivo y por tanto desestabiliza el anión, haciendo que los hidrógenos en alfa sean menos ácidos que en los aldehídos
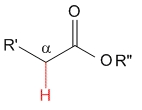 Éster
Éster
pKa = 25
Los grupos alcoxilo son fuertes dadores de electrones por efecto mesómero e inestabilizan todavía más el anión, haciendo que los hidrógenos en alfa a un éster sean los menos ácidos de esta serie.
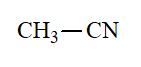 Nitrilo
Nitrilo
pKa = 31
El grupo nitrilo tiene la menor capacidad para estabilizar una carga negativa generada en posición alfa.
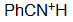 Benzo-nitrilo
Benzo-nitrilo
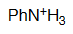 Anilina
Anilina
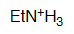 Etilamina
Etilamina
 Aldehído
Aldehído
 Cetona
Cetona
 Éster
Éster
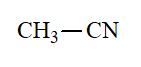 Nitrilo
Nitrilo