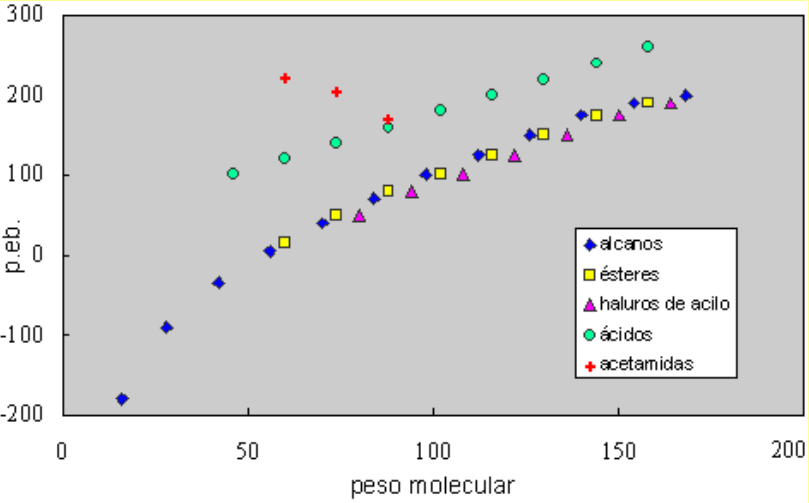
Las acetamidas tienen puntos de ebullición mucho más altos que los alcanos de peso molecular semejante. En una molécula pequeña, como las acetamidas, la polaridad del grupo amida sí aporta cohesión intermolecular adicional.
La acetamida, la N-metilacetamida y la N,N-dimetilacetamida tienen puntos de ebullición de 220º, 200º y 170ºC, aproximadamente.
La cohesión intermolecular es mayor en la acetamida, que puede formar enlaces de hidrógeno intermoleculares por medio de los dos grupos N-H.
La N-metilacetamida sólo tiene un NH y, por tanto, una posibilidad menor de formar una red compleja de enlaces de hidrógeno. Eso explica su menor punto de ebullición.
La N,N-dimetilacetamida no tiene grupos NH y no forma enlaces de hidrógeno, con lo que tiene el menor punto de ebullición en la serie.