EJEMPLOS DE ESPECTROS RMN DE OTROS ISÓTOPOS
Si estamos analizando una molécula que contiene heteroátomos, es decir, átomos diferentes de 1H y 13C, el registro del espectro de RMN a la frecuencia propia de esos heteronúcleos puede ser muy revelador de aspectos estructurales.
Los heteroátomos más útiles son los que poseen un momento de spin nuclear I = ½ y tienen una abundancia natural alta como, por ejemplo, 19F y 31P, al 100%.
Son muchos los fármacos que contienen 19F y numerosas la moléculas con interés biológico que contienen 31P o ambos.
Mira los espectros de la molécula HOOC-C(CH3)3.
¿Qué ocurrirá si reemplazamos un átomo de hidrógeno de uno de los grupos metilo por uno de flúor?
La molécula será entonces HOOC-C(CH2F)(CH3)2 y le podremos registrar un espectro de 19F.
Pero, ¿ejercerá algún efecto el 19F sobre los espectros de 1H y 13C? Lo vas a entender muy fácilmente.
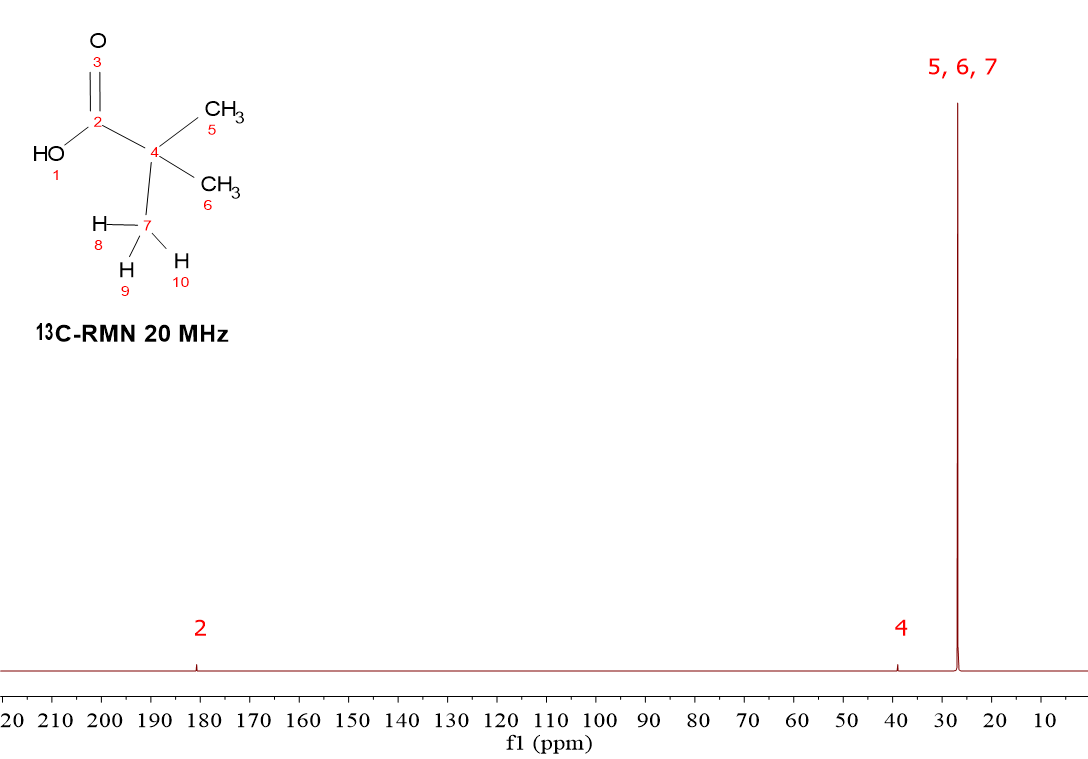
 HOOC-C(CH3)3
HOOC-C(CH3)3
 HOOC-C(CH2F)(CH3)2
HOOC-C(CH2F)(CH3)2
La diferencia más obvia entre las dos moléculas es la presencia del grupo CH2F, cuyos protones resuenan a un desplazamiento químico (4.25 ppm), mucho más alto que el de los grupos CH3 (1.2 ppm), fuertemente influido por la elevada electronegatividad del átomo del átomo de F.
Además, la señal del grupo CH2F aparece como un “doblete” porque, al ser el 19F activo en RMN y comportarse como un pequeño “imán”, la mitad de los F se alinean con el campo y la otra mitad en contra de él, con lo que los protones “ven” dos campos diferentes y por ello se obtiene un “doblete” (regla de N + 1, donde N = 1·F).
La constante de acoplamiento H-C-F a dos enlaces es relativamente elevada (en el entorno de los 40-50 Hz).
 HOOC-C(CH3)3
HOOC-C(CH3)3
 HOOC-C(CH2F)(CH3)2
HOOC-C(CH2F)(CH3)2
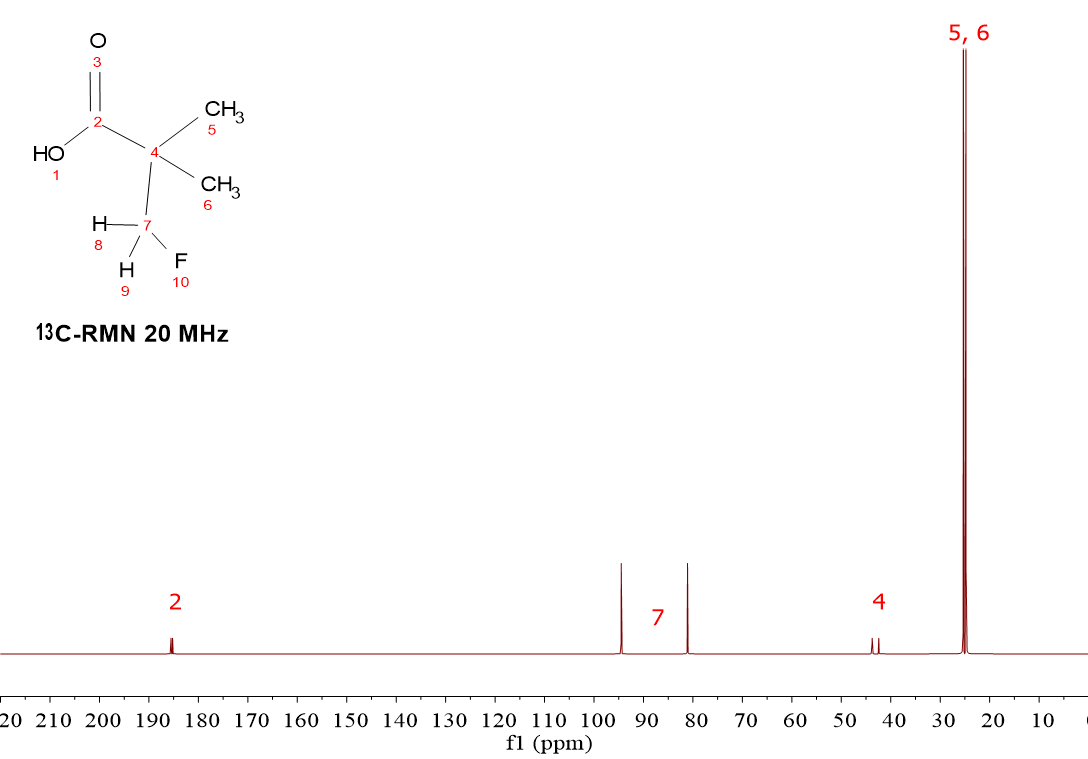
De nuevo la diferencia está en la presencia del grupo CH2F.
El carbono con el numeral arbitrario 7 sufre un incremento de desplazamiento químico por su unión directa al átomo de 19F y el efecto de electronegatividad de éste, que le “desnuda” de densidad electrónica.
Además, la presencia del átomo de 19F activo en RMN y su alineamiento a favor y en contra del campo externo hace que el carbono 7 aparezca como un “doblete”.
En realidad, todos los carbonos “ven” dos campos magnéticos y aparecen como “dobletes”. La magnitud del desdoblamiento es inversamente proporcional a la distancia en enlaces de cada carbono con el átomo de 19F.
 HOOC-C(CH2F)(CH3)2
HOOC-C(CH2F)(CH3)2
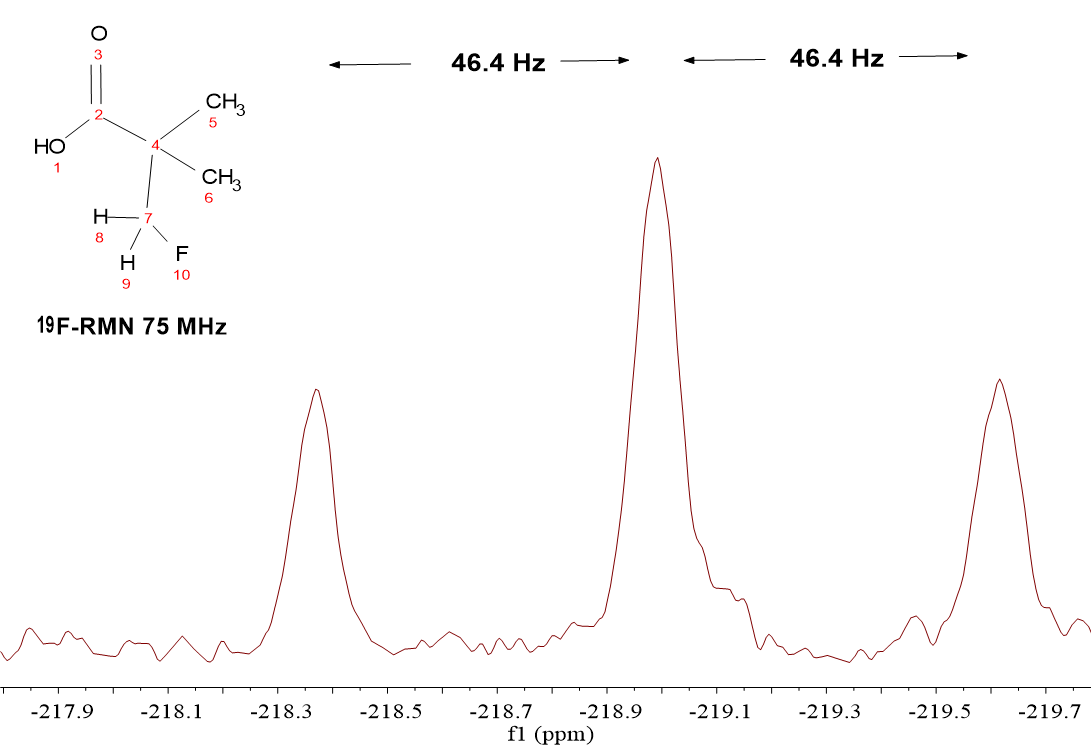
El 19F tiene una constante giromagnética muy próxima a la del 1H (251.7 y 267.5 · 10^6 rad·s^-1·T^-1) y su frecuencia de resonancia está muy cercana a la de 1H (75 MHz para 19F en comparación con 80 MHz para 1H en un campo de 1.8 Tesla).
A pesar de ello, se obtienen espectros de 19F sin afectar a 1H o viceversa.
Podemos ver que la señal que se obtiene del átomo de 19F es un “triplete” a un desplazamiento químico (-219 ppm) de una cuantía que pasaremos por alto en este momento.
La forma de “triplete” se explica porque en el grupo CH2F hay dos 1H's que obviamente son activos en RMN. En una cuarta parte de las moléculas los dos 1H del grupo CH2F se alinean con el campo, en otra cuarta parte se alinean los dos en contra del campo y en las dos cuartas partes que faltan, un protón se alinea a favor y otro en contra del campo externo.
Por tanto, el 19F ve “tres” campos, el reforzado por los dos protones alineados a favor del campo externo, el disminuido por los dos protones alineados en contra del campo y el campo externo, ya que la situación en la que un protón está a favor y otro en contra no aporta ningún campo adicional.
Esta será la señal central del “triplete” que es doblemente intensa porque la probabilidad de que los protones se opongan el uno al otro es doble. La constante de acoplamiento es idéntica a la observada en el espectro de 1H, ya que el acoplamiento es un fenómeno recíproco.
Si la molécula a considerar hubiera contenido un átomo de 31P, el fenómeno habría sido similar.
Pero, ¿qué ocurre cuando nos enfrentamos a núcleos activos en RMN pero de abundancia baja?
El mejor ejemplo lo tenemos en el propio 13C. Hemos visto que el 19F y el 31P, con abundancias del 100%, producen desdoblamientos en las señales del espectro de 1H.
¿Produce el 13C desdoblamientos similares?
La respuesta es SÍ, pero sólo en el 1% de las moléculas que poseen 13C ya que esa es la abundancia natural de ese isótopo.
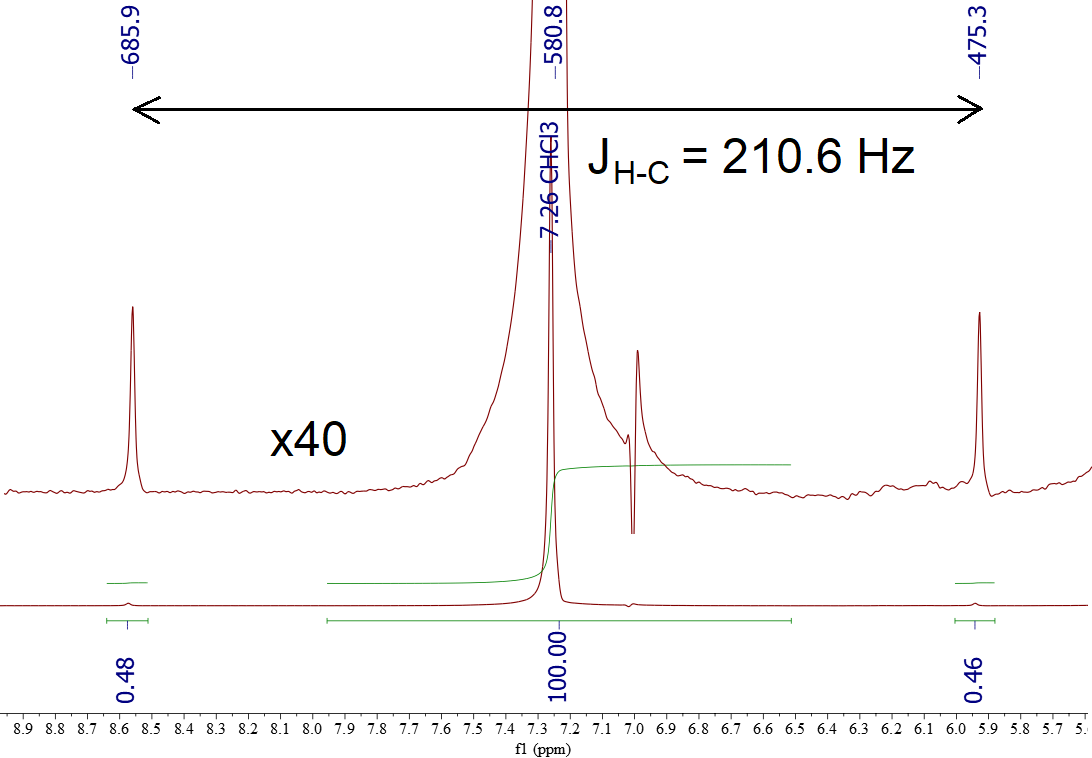
Mira el espectro del cloroformo CHCl3.
Si ampliamos el espectro verticalmente, a izquierda y derecha de la señal principal aparecen otras dos, denominadas “satélites” que corresponden al 1% de las moléculas que son 13CHCl3.
La constante de acoplamiento H-13C es enorme (210.6 Hz) porque ambos núcleos están directamente unidos y la influencia de ambos imanes nucleares es máxima.
En el 99% restante de las moléculas, que son 12CHCl3, no se observa desdoblamiento alguno ya que el 12C NO es activo en RMN.
Por tanto, todas las señales de 1H que están unidas a carbono muestran a derecha e izquierda unos “satélites” propios de la presencia del 1% de 13C, que debemos ser cuidadosos en no confundir con posibles impurezas del producto.
 HOOC-C(CH3)3
HOOC-C(CH3)3 HOOC-C(CH2F)(CH3)2
HOOC-C(CH2F)(CH3)2 HOOC-C(CH3)3
HOOC-C(CH3)3 HOOC-C(CH2F)(CH3)2
HOOC-C(CH2F)(CH3)2 HOOC-C(CH2F)(CH3)2
HOOC-C(CH2F)(CH3)2