EL MAGNETISMO DE LOS NÚCLEOS ATÓMICOS
El nombre de Resonancia Magnética Nuclear (RMN) nos indica que es una técnica que tiene que ver con los núcleos. Pero no hay que asustarse. No tiene nada que ver con la radioactividad, algo que la palabra “NUCLEAR” siempre sugiere al gran público.
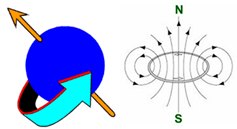 Representación esquemática del "spin nuclear".
Representación esquemática del "spin nuclear".
En la espectrometría de RMN, los núcleos son los protagonistas principales y los electrones pasan a tener un papel secundario, aunque muy importante.
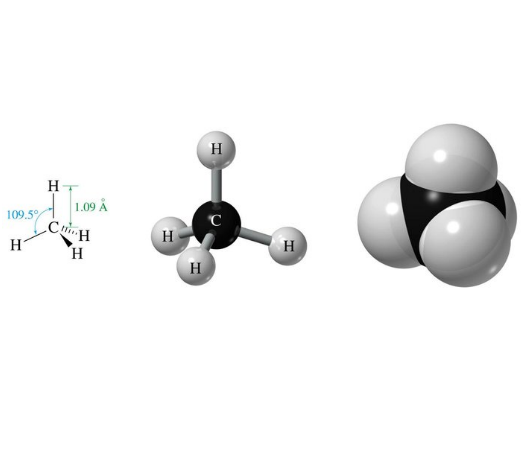
Muchos isótopos, de la enorme cantidad de ellos del Sistema Periódico, tienen núcleos atómicos que poseen propiedades magnéticas y, en definitiva, se comportan como imanes minúsculos. El ejemplo más sencillo de ellos es el núcleo de hidrógeno (1H) que tiene un solo protón, ningún neutrón y una abundancia natural cercana al 100%. Otro ejemplo importante es el núcleo de carbono, pero de su isótopo de masa 13.003 (13C) con 6 protones y 7 neutrones, cuya abundancia es ligeramente superior al 1%. Abundancia pequeña pero tangible.
¿Cuáles son los elementos generalmente más abundante y más importante, respectivamente, de una molécula orgánica? El hidrógeno y el carbono. ¿No sería extraordinario recibir una señal de cada uno de los núcleos de hidrógeno y carbono que están presentes en una molécula orgánica? Si supiéramos procesar esa información, podríamos obtener un mapa completo de la estructura molecular.
¡¡¡ Ello se logra registrando espectros de RMN !!!
Todas las partículas subatómicas, protones y neutrones, tienen una propiedad denominada “spin” que en castellano significa “giro”. Un núcleo es, en definitiva, una partícula con carga. Ocurre que, si el núcleo está constituido por un número impar de protones, de neutrones, o de los dos, como en 1H o 13C (¡¡¡ no en 12C !!!), el “spin” en exceso de la partícula impar crea un campo magnético y hace que el núcleo en cuestión se comporte como un minúsculo imán. Las moléculas orgánicas tienen entonces numerosos “imanes” en su estructura porque el 100% de los núcleos de 1H y el 1% de 13C lo son.
Considera ahora la molécula más sencilla en Química Orgánica: el metano (CH4). Está compuesta de un carbono, del que el 1% es 13C, y cuatro hidrógenos 100% 1H. La molécula es totalmente simétrica y los cuatro hidrógenos son espacialmente equivalentes e indistinguibles. Tenemos entonces “cinco imanes”, cuatro equivalentes e indistinguibles que son los cuatro 1H,y otro diferente, que es el 13C al 1%.
Reflexiona ahora y piensa de otra forma diferente. El metano se compone entonces de “dos tipos de moléculas”. Un 99% de 12C(1H)4 y un 1% de 13C(1H)4. Las moléculas mayoritarias de 12C(1H)4 sólo tienen “cuatro” imanes porque el 12C, al tener un número par de protones (6) y de neutrones (6), tiene “spin” o “giro” de sus partículas subatómicas pero la paridad hace que no se pueda crear momento magnético. Sin embargo, el 1% de las moléculas 13C(1H)4 sí tienen cinco imanes, cuatro 1H equivalentes y otro diferente 13C.
Esta reflexión es importante que la recuerdes para capítulos próximos.
 Representación esquemática del "spin nuclear".
Representación esquemática del "spin nuclear".