ALGUNOS EJEMPLOS PREVIOS (13C-RMN)
Empecemos a "descifrar" espectros...
Sólo recordarte que, en el caso del carbono, “el isótopo activo en RMN” es el 13C cuya abundancia natural es el 1.1%.
Esto es una gran diferencia con el hidrógeno porque, en el caso del carbono “perdemos” el 98.9% de los núcleos que son 12C NO ACTIVOS en RMN.
Esto afecta a la sensibilidad y se necesita más muestra y/o más tiempo para registrar un espectro de 13C en comparación con uno de 1H.
Pero hoy día los espectros de 13C-RMN son rutina...
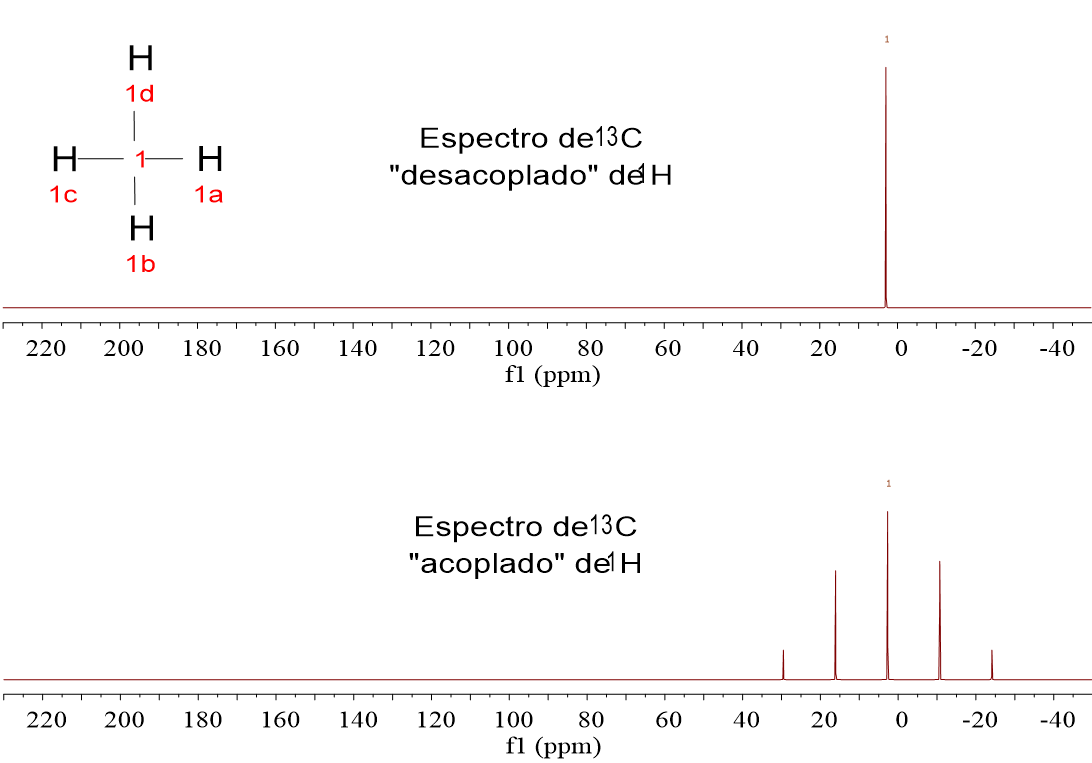
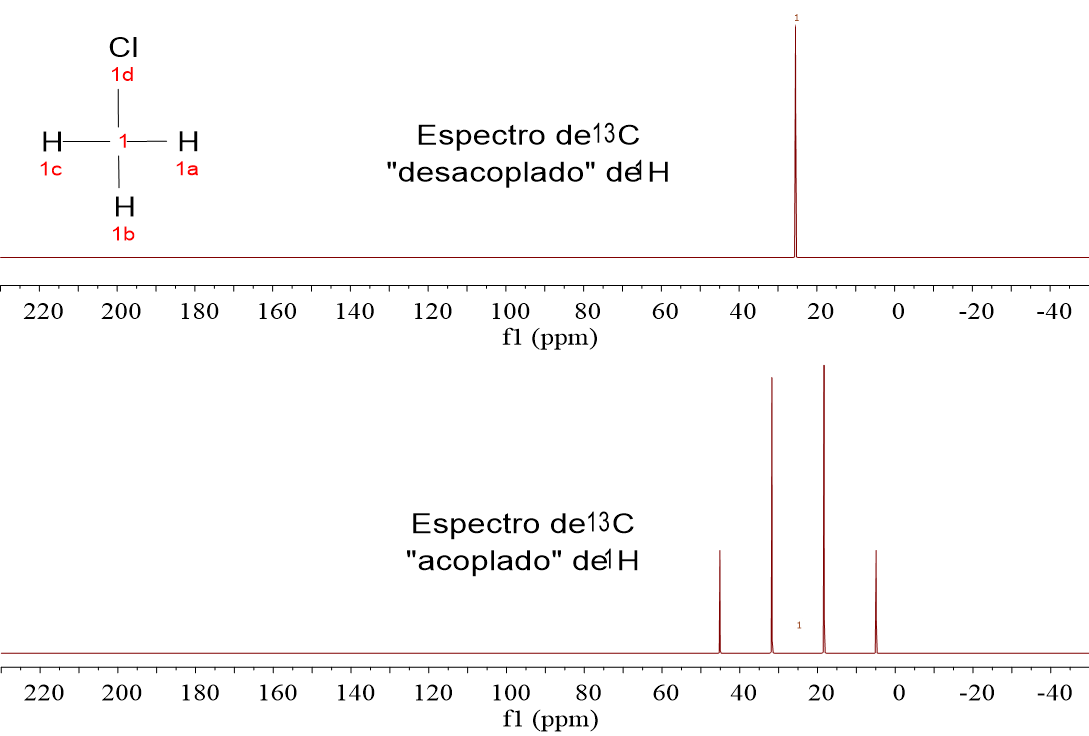
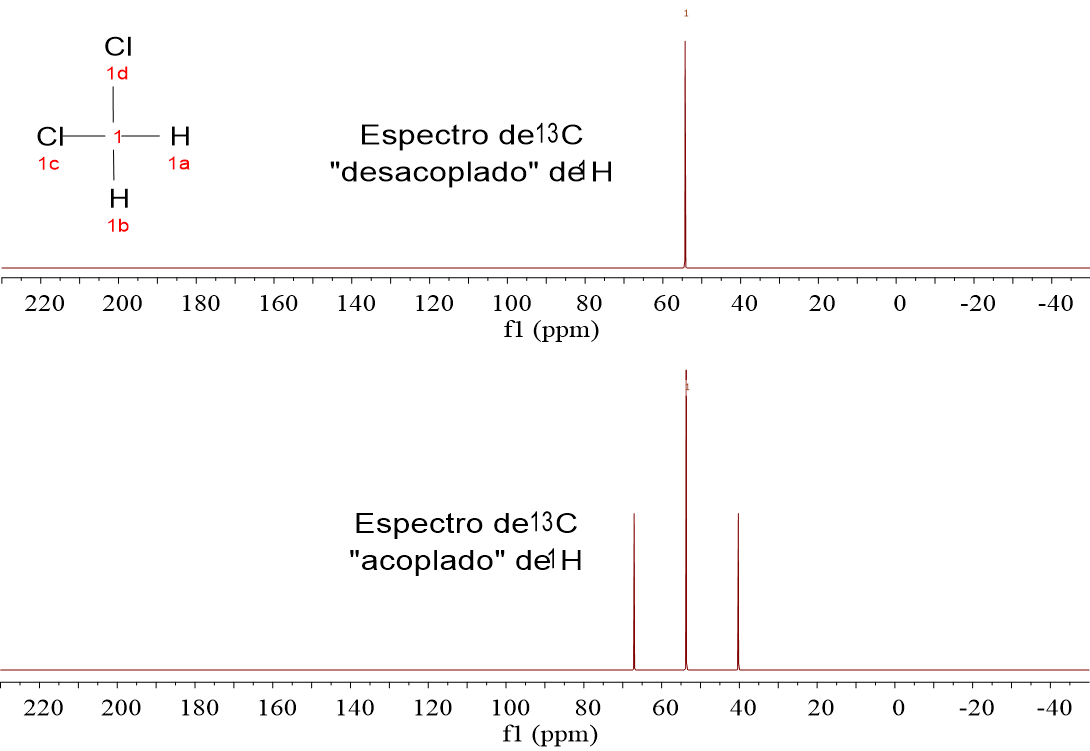
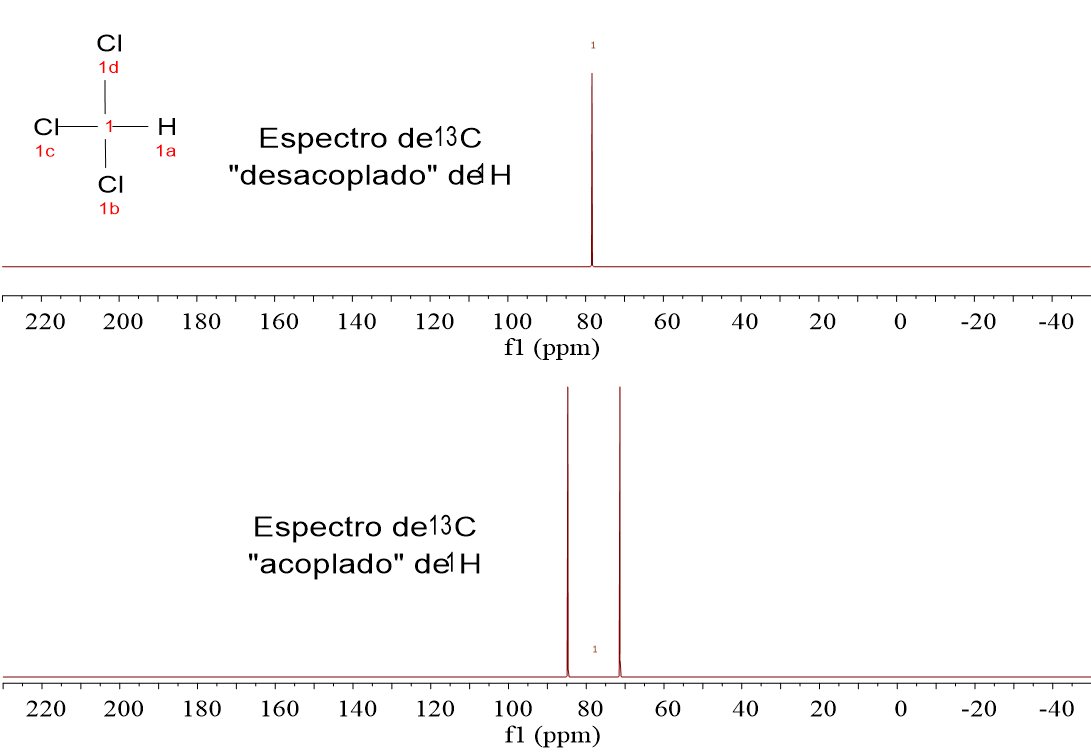
Mira estos cuatro espectros de carbono (13C). Pertenecen a las cuatro moléculas muy sencillas que analizamos en 1H-RMN:CH4, CH3Cl, CH2Cl2 y CHCl3.
¿Qué descubres en ellos?
Hay dos espectros diferentes registrados para cada uno. Los de la parte inferior son los espectros registrados directamente de las muestras, “sin hacer nada”.
Fíjate que el 13C sale como un “quintete” para el CH4, un “cuartete” para el CH3Cl, un “triplete” para el CH2Cl y un “doblete” para el CHCl3. ¿No te suena esto a la regla de N+1 del desdoblamiento?
¿Quién es responsable de N? Efectivamente el 1H.
El 1.1% de cada una de las moléculas anteriores contiene un 100% de 1H, es decir, el 13C está “influenciado” por los pequeños imanes de 1H.
Los “imanes son imanes” y entre ellos interaccionan, independientemente de que sean el mismo tipo de núcleo o no.
Pero que quede ya para lo sucesivo:
LOS ESPECTROS DE 13C SIEMPRE SE REGISTRAN “DESACOPLADOS” DE 1H, porque así se simplifican y se aumenta la respuesta del exiguo 1.1% de 13C que se puede observar, al hacer confluir las señales de los multipletes en una sola.
Así que vamos a olvidarnos de momento de los espectros “acoplados de 1H” y miremos a los “desacoplados de 1H”, en los que los carbonos aparecen SIEMPRE como un singlete.
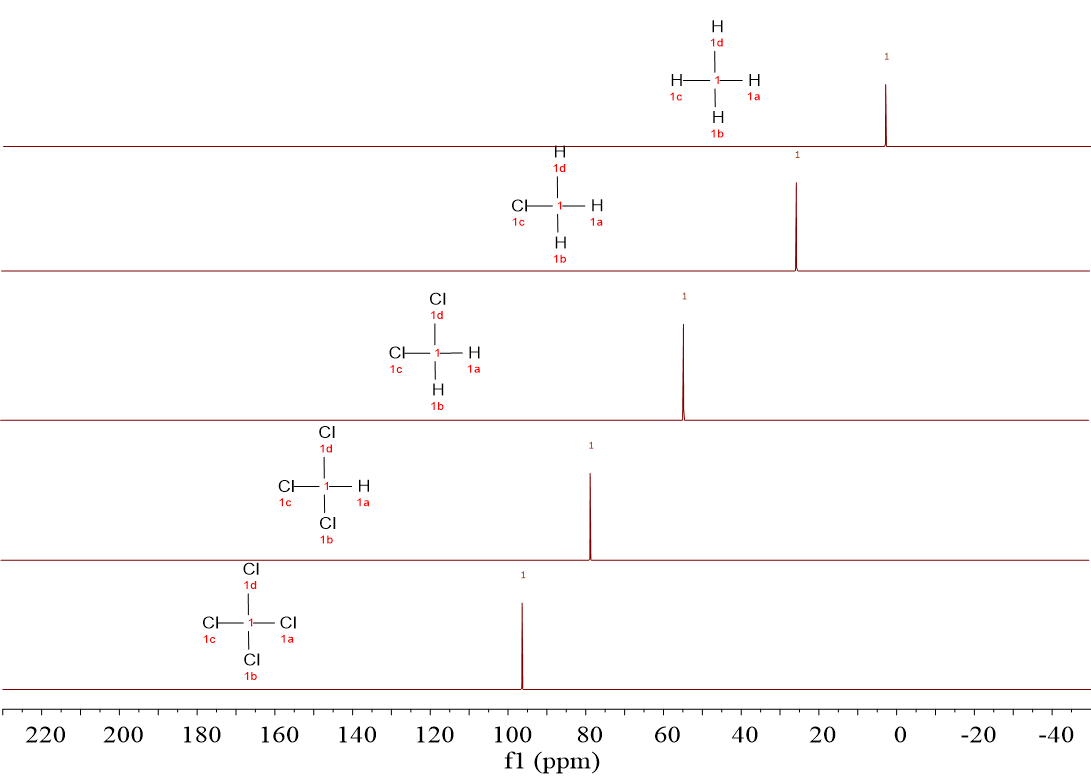
A la serie de espectros anteriores añadimos uno más: el del CCl4.
Lo primero que tiene que saltar a la vista en comparación con 1H es la escala horizontal, que en vez de estar en las “decenas” de ppm, está en los “centenares” de ppm.
¿Cuáles son los “desplazamientos químicos” del 13C de estas moléculas?
Desde casi 0.0 ppm en CH4 hasta casi 100 ppm en CCl4, pasando por situaciones intermedias progresivas a medida que aumenta el número de átomos de Cl.
¿Tiene esto lógica?
Efectivamente, a medida que hay más átomos de Cl, la señal se va desplazando a la izquierda, hacia unidades horizontales (“desplazamiento químico”) más elevadas. Igual que en 1H-RMN.
Al igual que en 1H, acabas de “redescubrir” el primer criterio para “descifrar” espectros:
Los 13C “resuenan a diferente desplazamiento químico” dependiendo de su entorno químico, es decir, dependiendo de la naturaleza de los átomos circundantes.
Veamos unos últimos espectros, que también presentamos en 1H, los que corresponden a CH2CH2CH3 y CH3CHClCH3, pero ahora en 13C-RMN.
¿Qué te llama la atención? Varias cosas. Antes de seguir leyendo haz una lista y mira después a ver si coincidimos.
1) En cada espectro hay más de una señal.
2) No se han medido las integrales.
3) Los "desplazamientos químicos" no son iguales.
4) Las señales son sólo singletes.
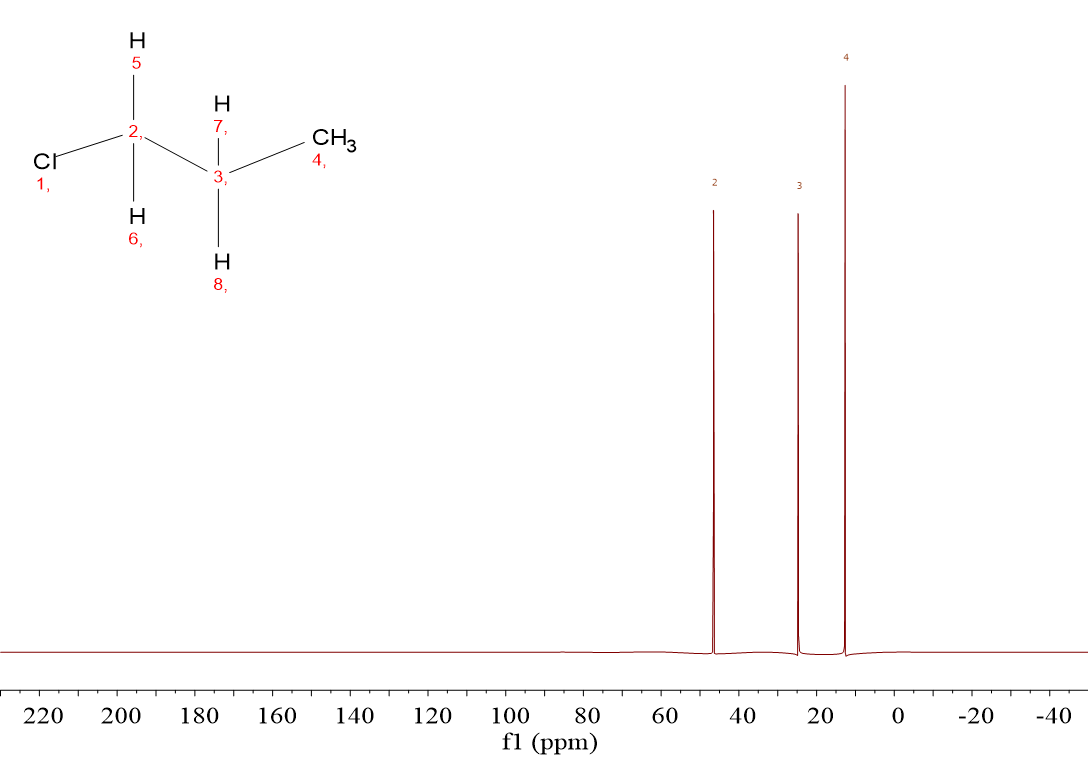 El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de carbonos: el del grupo ClCH2, el del CH2 intermedio y el del CH3.
El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de carbonos: el del grupo ClCH2, el del CH2 intermedio y el del CH3.
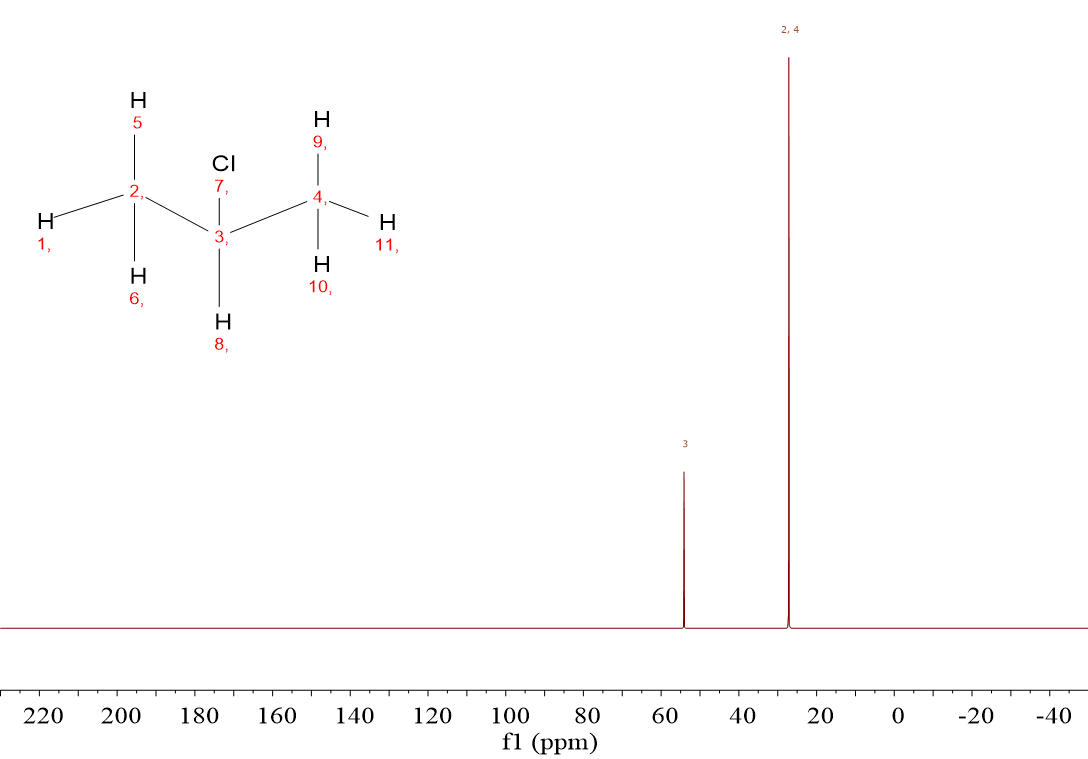 El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de carbonos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de carbonos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
 Las tres señales del ClCH2CH2CH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. Además rara vez alguna señal responde a más de un 13C.
Las tres señales del ClCH2CH2CH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. Además rara vez alguna señal responde a más de un 13C.
 Las dos del CH3CHClCH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. En este caso los grupos CH3 son equivalentes y la intensidad de su señal es especialmente intensa pero no exactamente el doble que la otra.
Las dos del CH3CHClCH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. En este caso los grupos CH3 son equivalentes y la intensidad de su señal es especialmente intensa pero no exactamente el doble que la otra.
 En el ClCH2CH2CH3 los desplazamientos químicos son 45 ppm, 25 ppm y 12 ppm. ¿Cómo las asignamos a los tres 13C?
En el ClCH2CH2CH3 los desplazamientos químicos son 45 ppm, 25 ppm y 12 ppm. ¿Cómo las asignamos a los tres 13C?
Exacto: por su proximidad al Cl.
La señal a 45 ppm debe asignarse al grupo CH2Cl, la de 25 ppm debe asignarse al CH2 intermedio y la de 12 ppm al grupo CH3.
De nuevo la proximidad al Cl marca el desplazamiento químico al que salen los hidrógenos: CH2Cl (1 enlaces), 45 ppm; CH2 intermedio (2 enlaces), 25 ppm y CH3 (3 enlaces), 12 ppm.
 En el CH3CHClCH3 se observa un desplazamiento químico muy alto (52 ppm) y otro más bajo (25 ppm). La señal más intensa debe corresponder a los dos 13C equivalentes. Los desplazamientos obedecen entonces a la cercanía al átomo de Cl, como sucedía en los espectros de 1H-RMN, aunque cada uno en su rango de ppm. Parece que la proximidad al Cl (un enlace) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (dos enlaces) aparezcan a un desplazamiento químico mucho menor.
En el CH3CHClCH3 se observa un desplazamiento químico muy alto (52 ppm) y otro más bajo (25 ppm). La señal más intensa debe corresponder a los dos 13C equivalentes. Los desplazamientos obedecen entonces a la cercanía al átomo de Cl, como sucedía en los espectros de 1H-RMN, aunque cada uno en su rango de ppm. Parece que la proximidad al Cl (un enlace) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (dos enlaces) aparezcan a un desplazamiento químico mucho menor.
Tan sólo queda por señalar, aunque ya lo hemos mencionado, que no hay “forma” en las señales: todas son “singletes”.
Piensa que eso es un inconveniente porque si cada 13C mostrara la forma de “multiplete” en función de los hidrógenos a que está unido, podríamos saber fácilmente en principio si la señal pertenece a un CH3 (“posible cuartete”), un CH2 (“posible triplete”) un CH (“posible doblete”) o un C (“singlete”).
Pero para moléculas complejas la superposición de señales sería muy grande y la sensibilidad sufre, necesitándose más cantidad de muestra y/o más tiempo de adquisición de datos. Ten en mente esto porque hay otros métodos para extraer esa información de manera muy sencilla a la hora de la interpretación. En las secciones siguientes lo explicaremos.


 El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de carbonos: el del grupo ClCH2, el del CH2 intermedio y el del CH3.
El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de carbonos: el del grupo ClCH2, el del CH2 intermedio y el del CH3.
 El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de carbonos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de carbonos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
 Las tres señales del ClCH2CH2CH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. Además rara vez alguna señal responde a más de un 13C.
Las tres señales del ClCH2CH2CH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. Además rara vez alguna señal responde a más de un 13C.
 Las dos del CH3CHClCH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. En este caso los grupos CH3 son equivalentes y la intensidad de su señal es especialmente intensa pero no exactamente el doble que la otra.
Las dos del CH3CHClCH3 no se integran porque la intensidad en 13C no responde exactamente al número de carbonos. En este caso los grupos CH3 son equivalentes y la intensidad de su señal es especialmente intensa pero no exactamente el doble que la otra.
 En el ClCH2CH2CH3 los desplazamientos químicos son 45 ppm, 25 ppm y 12 ppm. ¿Cómo las asignamos a los tres 13C?
En el ClCH2CH2CH3 los desplazamientos químicos son 45 ppm, 25 ppm y 12 ppm. ¿Cómo las asignamos a los tres 13C? En el CH3CHClCH3 se observa un desplazamiento químico muy alto (52 ppm) y otro más bajo (25 ppm). La señal más intensa debe corresponder a los dos 13C equivalentes. Los desplazamientos obedecen entonces a la cercanía al átomo de Cl, como sucedía en los espectros de 1H-RMN, aunque cada uno en su rango de ppm. Parece que la proximidad al Cl (un enlace) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (dos enlaces) aparezcan a un desplazamiento químico mucho menor.
En el CH3CHClCH3 se observa un desplazamiento químico muy alto (52 ppm) y otro más bajo (25 ppm). La señal más intensa debe corresponder a los dos 13C equivalentes. Los desplazamientos obedecen entonces a la cercanía al átomo de Cl, como sucedía en los espectros de 1H-RMN, aunque cada uno en su rango de ppm. Parece que la proximidad al Cl (un enlace) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (dos enlaces) aparezcan a un desplazamiento químico mucho menor.

