Empecemos a "descifrar" espectros...
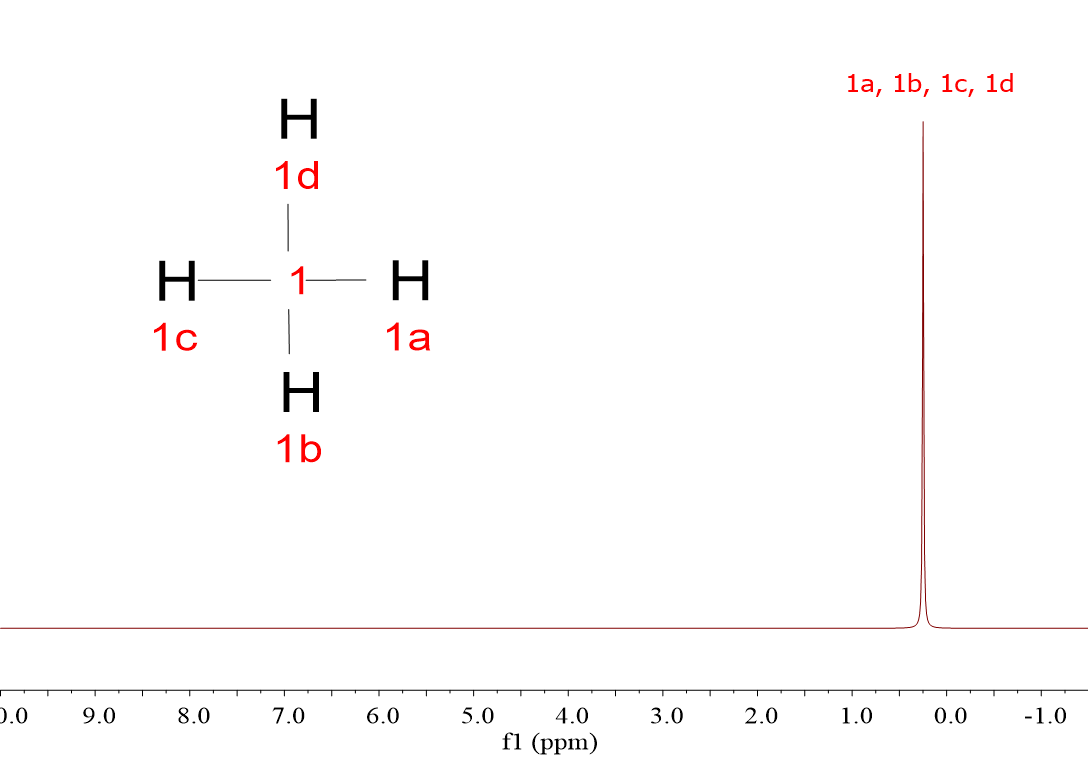
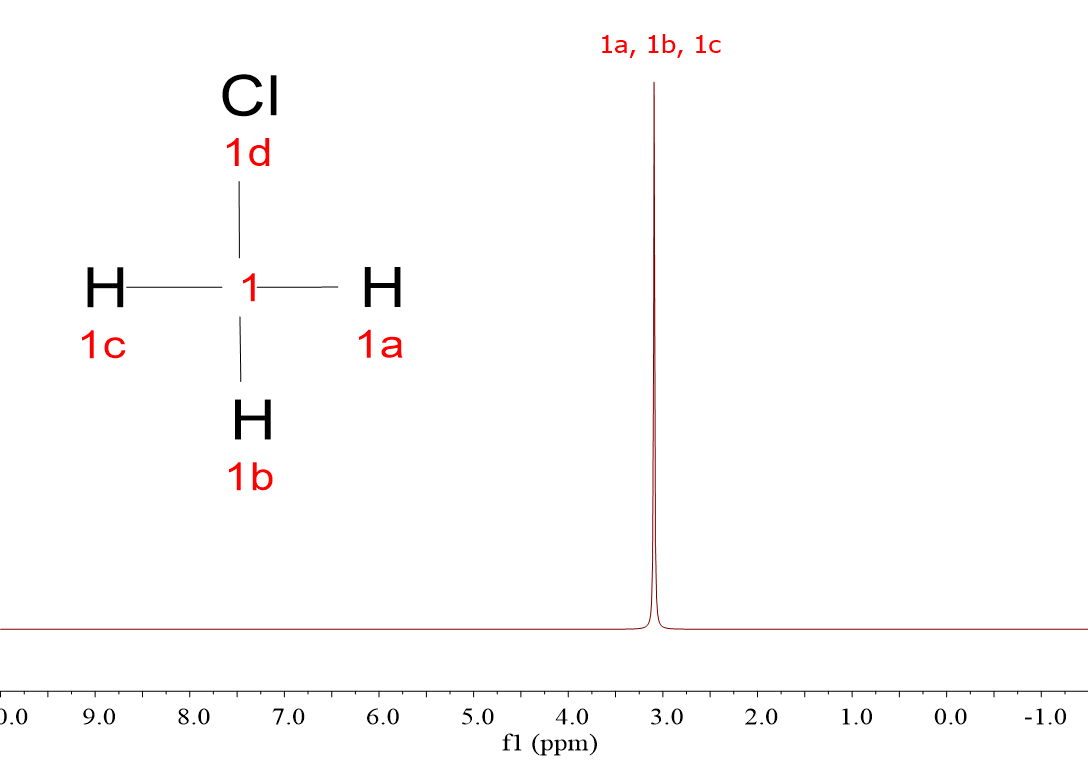
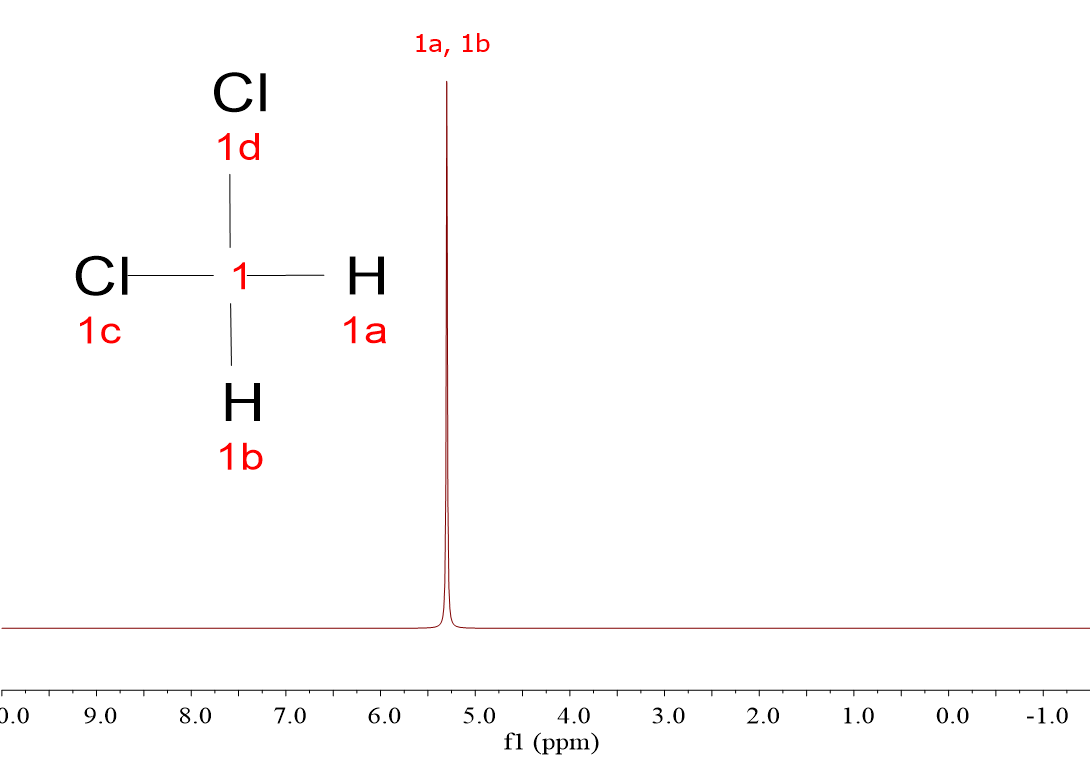
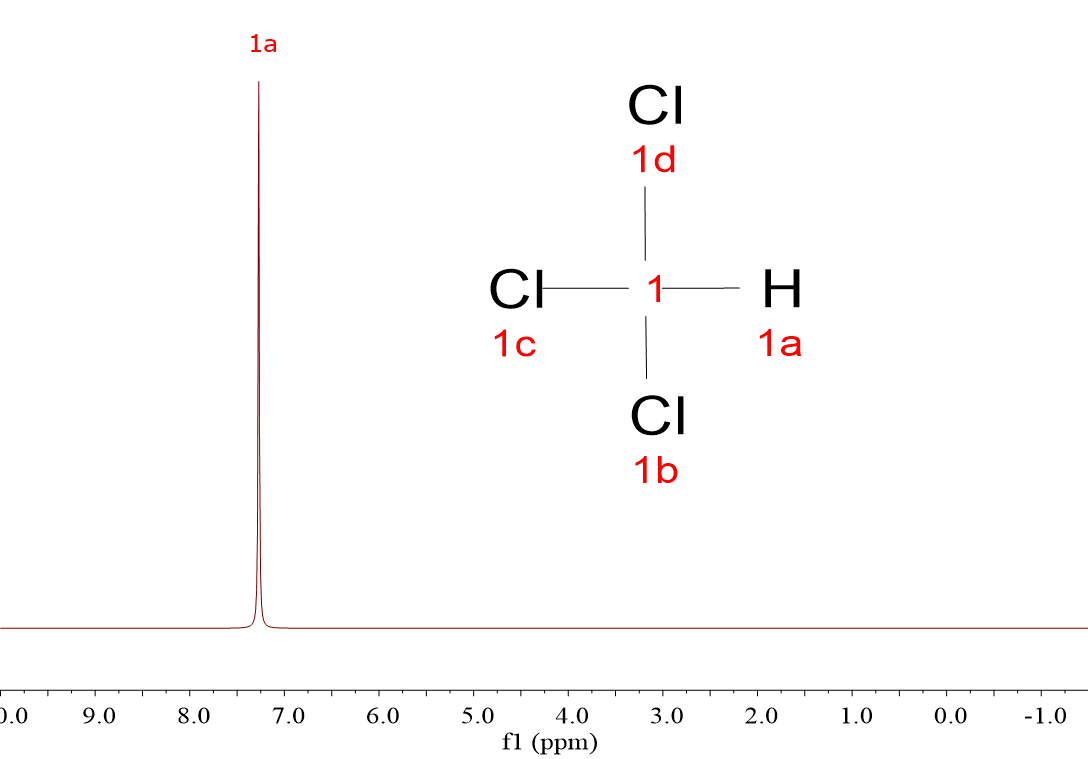
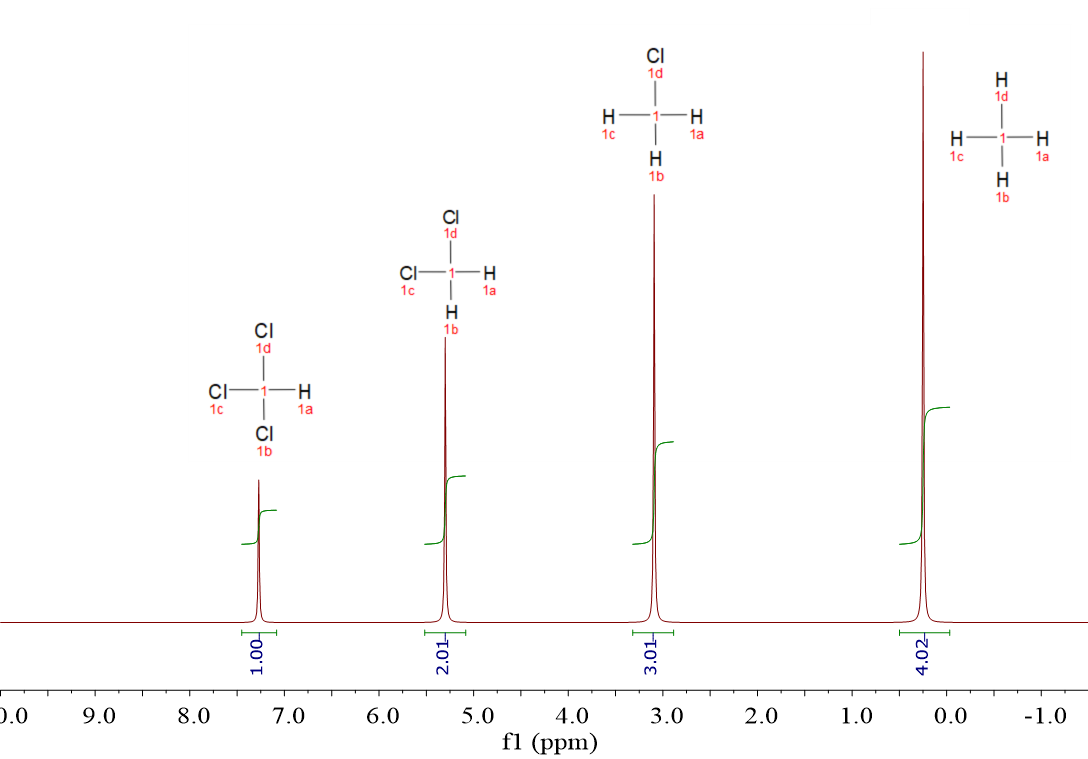
Mira estos cuatro espectros de hidrógeno (1H). Pertenecen a cuatro moléculas muy sencillas, muy parecidas, pero sus espectros son diferentes: CH4, CH3Cl, CH2Cl2 y CHCl3.
¿Qué descubres en ellos?
Las cuatro moléculas dan una única señal porque, a pesar de que hay tres que tienen más de un hidrógeno, los 1H dentro de cada molécula son equivalentes entre sí y “resuenan” de la misma forma.
¿Pero qué notas si comparas el lugar donde cada uno da su señal?
Efectivamente, a medida que hay más átomos de Cl, la señal se va desplazando a la izquierda, hacia unidades horizontales de “desplazamiento químico” más elevadas.
Acabas de descubrir el primer criterio para “descifrar” espectros: los hidrógenos “resuenan a diferente desplazamiento químico” dependiendo de su entorno químico, es decir, dependiendo de la naturaleza de los átomos circundantes.
Ahora supón que mezclamos cantidades equimoleculares de las cuatro moléculas y a la mezcla le registramos un espectro. ¿Qué crees que va a salir?
Has acertado: cuatro señales a los “desplazamientos químicos” de cada compuesto individual.
Pero, ¿notas algo más?
Claro que sí: las intensidades no son iguales, a pesar de que el número de moléculas de cada componente es exactamente el mismo. ¿Por qué?
Porque las moléculas tienen diferente número de hidrógenos. Hemos medido el área de cada señal (“integral”) y fíjate que las áreas relativas responden al número de hidrógenos que cada molécula tiene.
Acabas de descubrir el segundo criterio para “descifrar” espectros de RMN de hidrógeno:
El área de cada señal es proporcional al número de hidrógenos responsables de cada señal.
Veamos unos últimos espectros, los que corresponden al ClCH2CH2CH3 y CH3CHClCH3.
¿Qué te llama la atención? Varias cosas. Antes de seguir leyendo haz una lista y mira después a ver si coincidimos.
1) En cada espectro hay más de una señal.
2) Las señales tienen un patrón de integrales característico.
3) Los "desplazamientos químicos" no son iguales.
4) Las señales tienen formas propias.
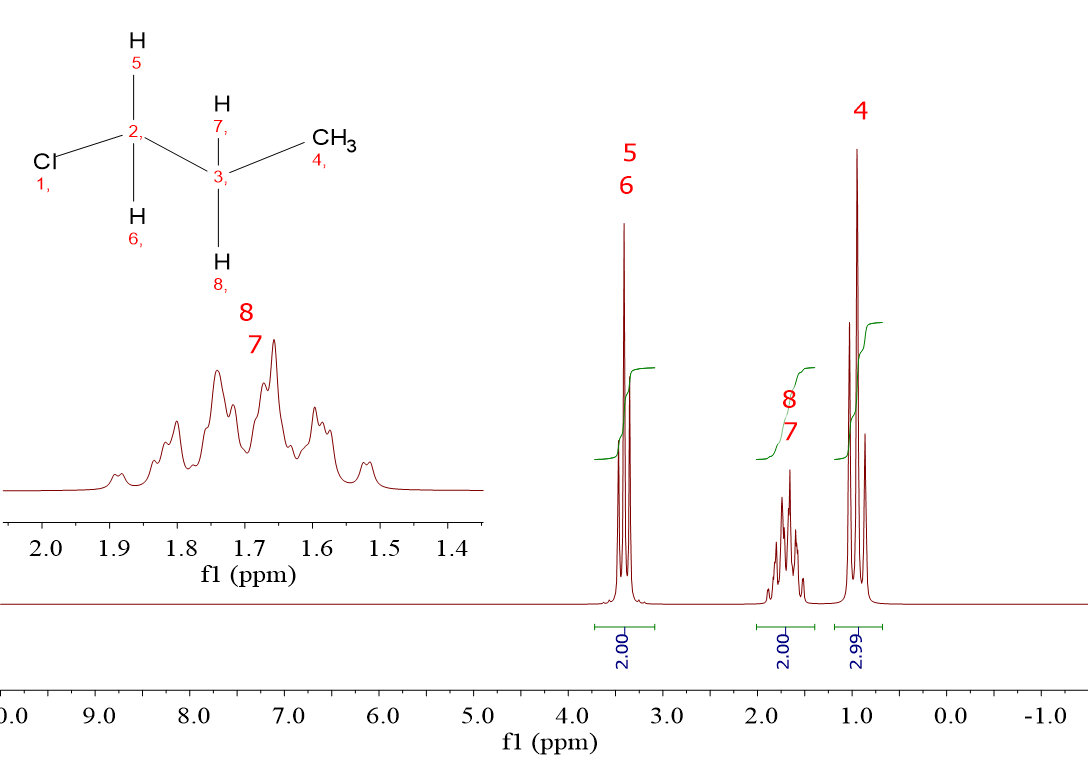 El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de hidrógenos: los del grupo ClCH2, los del CH2 intermedio y los del CH3.
El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de hidrógenos: los del grupo ClCH2, los del CH2 intermedio y los del CH3.
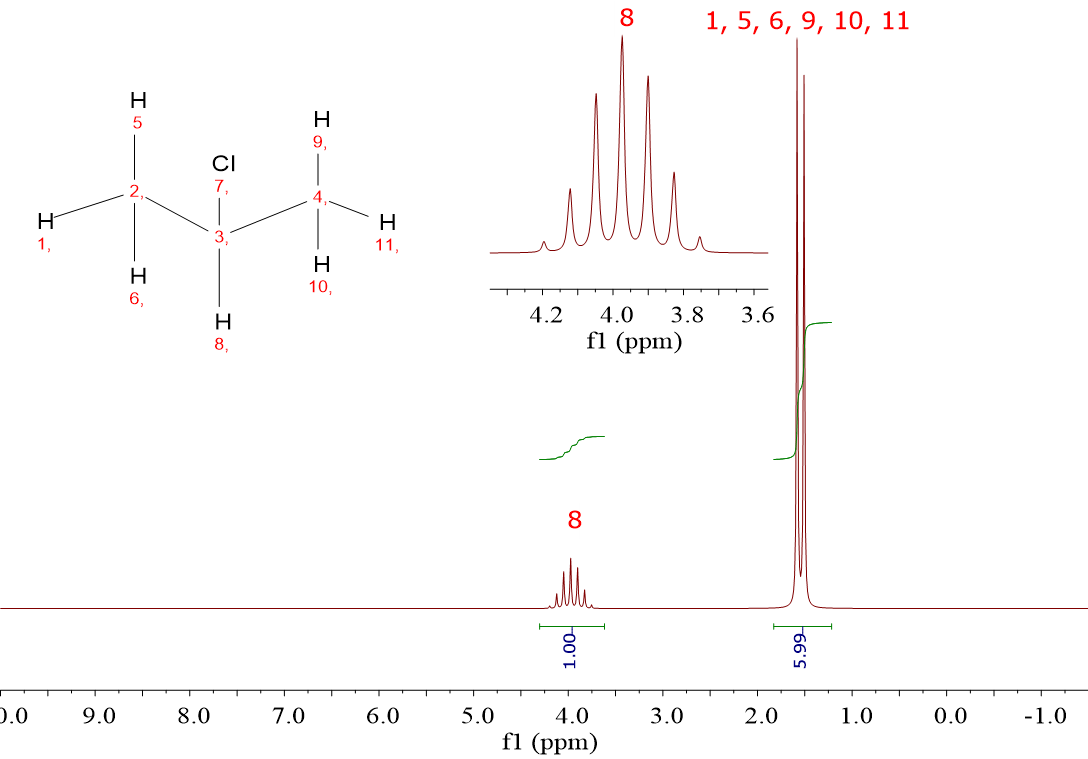 El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de hidrógenos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de hidrógenos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
 Las tres señales del ClCH2CH2CH3 integran para 2, 2 y 3, de acuerdo al número de hidrógenos de cada grupo.
Las tres señales del ClCH2CH2CH3 integran para 2, 2 y 3, de acuerdo al número de hidrógenos de cada grupo.
 Las dos del CH3CHClCH3 lo hacen para 1 y 6, también en acuerdo al número de hidrógenos de cada grupo.
Las dos del CH3CHClCH3 lo hacen para 1 y 6, también en acuerdo al número de hidrógenos de cada grupo.
 En el ClCH2CH2CH3 los desplazamientos químicos son 3.4 ppm, 1.7 ppm y 0.9 ppm.
En el ClCH2CH2CH3 los desplazamientos químicos son 3.4 ppm, 1.7 ppm y 0.9 ppm.
Este último corresponde a una señal que integra para 3 así que sabemos que pertenece al CH3. Pero, ¿cómo asignamos los otros dos cuya integral es la misma? Exacto: por su proximidad al Cl. La señal a 3.4 ppm debe asignarse al grupo CH2Cl, mientras que la de 1.7 ppm debe asignarse al CH2 intermedio. De nuevo la proximidad al Cl marca el desplazamiento químico al que salen los hidrógenos: CH2Cl (2 enlaces), 3.4 ppm; CH2 intermedio (3 enlaces), 1.7 ppm y CH3 (4 enlaces), 0.9 ppm.
 En el CH3CHClCH3 se observa un desplazamiento químico muy alto (3.95 ppm) y otro más bajo (1.5 ppm). Por las integrales sabemos que el de desplazamiento químico más alto es el grupo CH, cuyo hidrógeno es el que está más cerca del Cl. ¿Recuerdas los primeros ejemplos? ¿A qué desplazamiento se parece más el 3.95 ppm observado? Al compuesto que tenía un solo Cl (3.0 ppm). Tiene sentido. Parece que la proximidad al Cl (2 enlaces) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (3 enlaces), aparecen a un desplazamiento químico mucho menor.
En el CH3CHClCH3 se observa un desplazamiento químico muy alto (3.95 ppm) y otro más bajo (1.5 ppm). Por las integrales sabemos que el de desplazamiento químico más alto es el grupo CH, cuyo hidrógeno es el que está más cerca del Cl. ¿Recuerdas los primeros ejemplos? ¿A qué desplazamiento se parece más el 3.95 ppm observado? Al compuesto que tenía un solo Cl (3.0 ppm). Tiene sentido. Parece que la proximidad al Cl (2 enlaces) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (3 enlaces), aparecen a un desplazamiento químico mucho menor.
 Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.
Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.
Para el ClCH2CH2CH3 un “triplete” a 0.9 ppm, un “sextete complejo” a 1.7 ppm y un “triplete” a 3.4 ppm.
La señal a 0.9 ppm del grupo CH3 aparece como un “triplete” porque tiene los dos hidrógenos del CH2 intermedio como vecinos. LA VECINDAD SE REDUCE A LA POSICIÓN CONTIGUA. Por ello es por lo que el grupo ClCH2 también sale como un “triplete”, debido también a los dos hidrógenos del CH2 intermedio. ¿Cuántos vecinos tiene el CH2 intermedio? Tiene 5 hidrógenos, dos del grupo CH2Cl y tres del grupo CH3. Por ello sale como un “sextete” fundamentalmente, aunque el hecho de que los dos grupos de hidrógenos vecinos, CH2Cl y CH3 no sean equivalentes entre sí complica la situación y hace que el sextete sea “complejo”. Lo explicaremos más adelante.
 Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.
Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.
Para el CH3CHClCH3 se observa un “septete” a 3.95 ppm y un “doblete” a 1.5 ppm.
Los hidrógenos de los grupos CH3 equivalentes solo tienen “un vecino”: el CH.
Se obtiene un “doblete”, es decir, el número de vecinos más uno.
¿Por qué sale la señal del CH como un “septete”?
¿Número de vecinos más uno?
Efectivamente, porque tiene SEIS VECINOS, los hidrógenos de los dos grupos CH3.
Acabas de descubrir el tercer rasgo importante de los espectros de 1H-RMN: los “acoplamientos”.
Los acoplamientos producen desdoblamientos en las señales que nos informan del “número de hidrógenos VECINOS” que cada grupo de hidrógenos tiene.


 El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de hidrógenos: los del grupo ClCH2, los del CH2 intermedio y los del CH3.
El ClCH2CH2CH3 (1-cloropropano) da tres señales porque hay tres tipos de hidrógenos: los del grupo ClCH2, los del CH2 intermedio y los del CH3.
 El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de hidrógenos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
El CH3CHClCH3 (2-cloropropano) da dos señales porque solo hay dos tipos de hidrógenos: el CHCl por un lado y los dos grupos CH3 equivalentes por otro.
 Las tres señales del ClCH2CH2CH3 integran para 2, 2 y 3, de acuerdo al número de hidrógenos de cada grupo.
Las tres señales del ClCH2CH2CH3 integran para 2, 2 y 3, de acuerdo al número de hidrógenos de cada grupo.
 Las dos del CH3CHClCH3 lo hacen para 1 y 6, también en acuerdo al número de hidrógenos de cada grupo.
Las dos del CH3CHClCH3 lo hacen para 1 y 6, también en acuerdo al número de hidrógenos de cada grupo.
 En el ClCH2CH2CH3 los desplazamientos químicos son 3.4 ppm, 1.7 ppm y 0.9 ppm.
En el ClCH2CH2CH3 los desplazamientos químicos son 3.4 ppm, 1.7 ppm y 0.9 ppm. En el CH3CHClCH3 se observa un desplazamiento químico muy alto (3.95 ppm) y otro más bajo (1.5 ppm). Por las integrales sabemos que el de desplazamiento químico más alto es el grupo CH, cuyo hidrógeno es el que está más cerca del Cl. ¿Recuerdas los primeros ejemplos? ¿A qué desplazamiento se parece más el 3.95 ppm observado? Al compuesto que tenía un solo Cl (3.0 ppm). Tiene sentido. Parece que la proximidad al Cl (2 enlaces) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (3 enlaces), aparecen a un desplazamiento químico mucho menor.
En el CH3CHClCH3 se observa un desplazamiento químico muy alto (3.95 ppm) y otro más bajo (1.5 ppm). Por las integrales sabemos que el de desplazamiento químico más alto es el grupo CH, cuyo hidrógeno es el que está más cerca del Cl. ¿Recuerdas los primeros ejemplos? ¿A qué desplazamiento se parece más el 3.95 ppm observado? Al compuesto que tenía un solo Cl (3.0 ppm). Tiene sentido. Parece que la proximidad al Cl (2 enlaces) hace que el desplazamiento químico aumente porque los grupos CH3, más lejanos (3 enlaces), aparecen a un desplazamiento químico mucho menor.
 Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.
Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.  Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.
Tan sólo queda por apreciar otro rasgo llamativo: “la forma” de las señales.