MI PRIMER ESPECTRO DE 13C-RMN
Te presento el espectro de 13C del ibuprofeno.
Ese analgésico que habrás tomado muchas veces, que tiene una fórmula molecular C13H18O2.
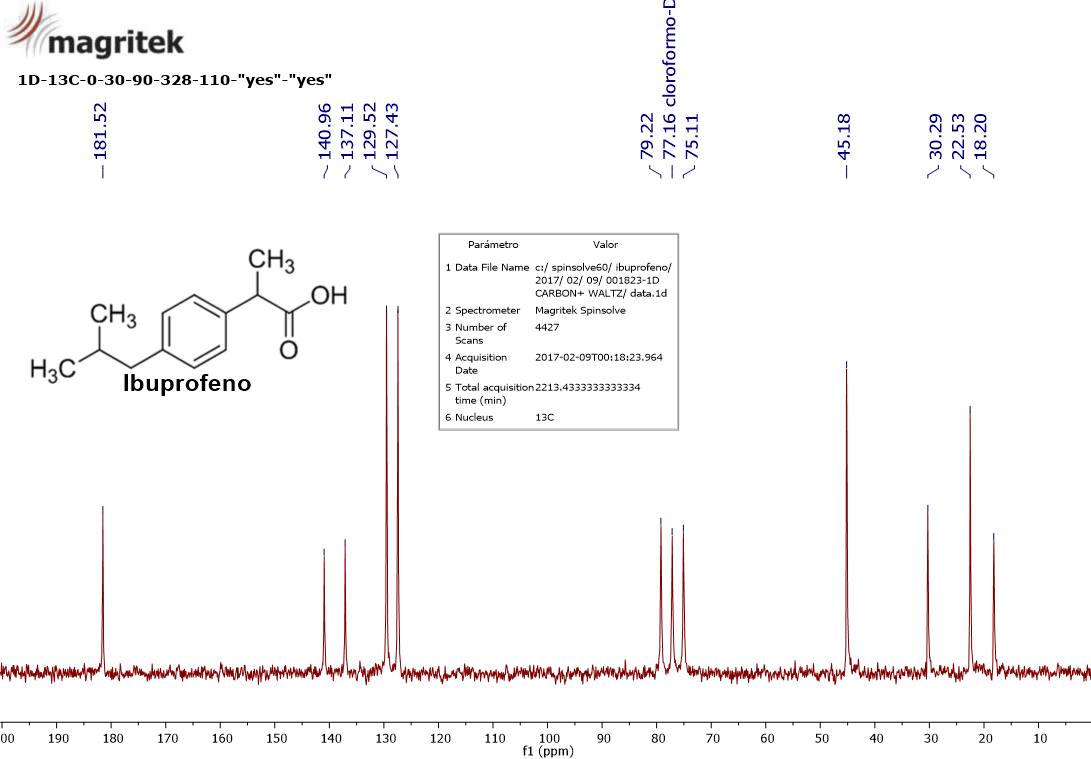 Espectro 13C-NMR del ibuprofeno.
Espectro 13C-NMR del ibuprofeno.
Todos los espectros de RMN, independientemente del núcleo que se observe, se caracterizan por una escala horizontal, denominada “desplazamiento químico”.
En 13C la escala va de 0 a 250 ppm (partes por millón; ¡¡¡ ya explicaremos que significa eso !!!) Compara con la de 1H (0 a 15 ppm).
En esa escala salen las señales de los diferentes 13C del compuesto que se trate. Afortunadamente no salen todas juntas porque si no, la RMN no serviría para determinar estructuras.
Contemos y diferenciemos carbonos de la estructura. Para ello utilizaremos criterios de simetría y el concepto de que los enlaces sencillos C-C giran libremente como un molinillo. Lee lo siguiente con atención, aunque haya cosas que no entiendas muy bien todavía.
¿Son todos los metilos equivalentes?
Hay dos que sí lo son entre sí: los del grupo (CH3)2C (isopropilo). Si los permutaras de sitio la molécula no cambiaría y, por ello, los dos carbonos deben dar una única señal.
Pero esos grupos metilo, equivalentes entre sí, son diferentes del otro que está arriba, cercano al grupo carboxilo (COO).
Por consiguiente, hay dos grupos metilo cuyos dos carbonos “viven en el mismo domicilio” pero diferente del “domicilio” del otro grupo metilo y su carbono.
Hay un grupo CH2 único en la molécula. Ahí tenemos “otro domicilio”.
Grupos CH hay de dos tipos: Los que están en el anillo y los que están fuera. Estos últimos no son equivalentes y cada grupo 13CH fuera del anillo tiene “su propio domicilio”.
De los del anillo podemos ver que, aunque son equivalentes por parejas, se parecen mucho. Viven “en dos domicilios” de dos carbonos cada uno, que son vecinos muy próximos.
Ya solo queda considerar los carbonos "no hidrogenados" que son dos no equivalentes en el anillo más el del grupo COOH.
¿Cuántos “domicilios” hemos averiguado?
1) El de los dos carbonos equivalentes de los metilos del grupo isopropilo (CH3)2.
2) El del otro grupo metilo.
3) El del grupo CH2.
4) Los dos de los grupos CH fuera del anillo.
5) Los dos de las parejas de grupos CH del anillo.
6) Los dos de los carbonos "no hidrogenados" del anillo.
7) El del grupo COOH.
En total “diez domicilios” diferentes, con uno o dos “habitantes” cada uno.
Echa un vistazo al espectro de nuevo y la escala horizontal. Quiero que descubras 9 señales a:
18.2 ppm
22.5 ppm
30.3 ppm
45.2 ppm
127.4 ppm
129.5 ppm
137.1 ppm
141.0 ppm
181.5 ppm
Las ves?
 Espectro 13C-NMR del ibuprofeno.
Espectro 13C-NMR del ibuprofeno.
Los espectros de 13C son más simples que los de 1H porque todas las señales son "singletes", a excepción de las de los disolventes, que hay que saber descubrir.
En este caso el disolvente es "cloroformo deuterado" (CDCl3; ya explicaremos qué es esto) que da el “triplete” centrado a 77.2 ppm.
Otro rasgo fundamental del espectro de 13C es que la escala de "desplazamiento químico" se extiende más allá de 200 ppm, en vez de las 10-15 ppm en 1H.
Otro detalle es la AUSENCIA DE INTEGRAL.
Desgraciadamente, en el caso de 13C, la intensidad de las señales no corresponde al número de carbonos, de la manera tan fidedigna como la integral o área de las señales de 1H lo hace en sus espectros con el número de hidrógenos.
Interpretemos tanto como podamos:
¿Cuantos carbonos tiene el ibuprofeno?
Su fórmula molecular es C13H18O2. ¿Observamos 13 señales de 13C? Sólo se ven 9, aparte de las tres del disolvente.
Recuerda que había dos grupos metilo equivalentes. Teniendo eso en cuenta, deberíamos ver doce señales, todavía demasiadas.
¿Y el anillo? Hay dos pares de carbonos equivalentes. Deduciendo esas equivalencias, todavía deberíamos esperar diez señales.
Debe existir una equivalencia adicional que debe ser accidental porque la simetría de la molécula no lo explica.
Ese es ciertamente un inconveniente en los espectros de RMN: la coincidencia accidental de señales.
Veremos muchos ejemplos a lo largo del curso.
Mira de nuevo el espectro. ¿No ves que las señales a 22.5 ppm, 45.2 ppm, 127,4 ppm y 129.5 ppm tienen de media una intensidad doble que la media del resto de las señales?
En los espectros de 13C eso sugiere, aunque no siempre, que sobre esas señales hay una equivalencia o coincidencia accidental de dos carbonos.
De esa manera conseguimos justificar las diez señales esperadas, dos de las cuales coinciden accidentalemente en desplazamiento químico, viéndose en total solo nueve.
Ya has entendido el primer espectro de 13C-RMN.
Todavía queda mucho por aprender pero, ¡¡¡ no desesperes !!!
Esta ha sido la primera aproximación y ¡¡¡ sin saber casi nada todavía !!!
Paso a paso...
 Espectro 13C-NMR del ibuprofeno.
Espectro 13C-NMR del ibuprofeno.
 Espectro 13C-NMR del ibuprofeno.
Espectro 13C-NMR del ibuprofeno.
