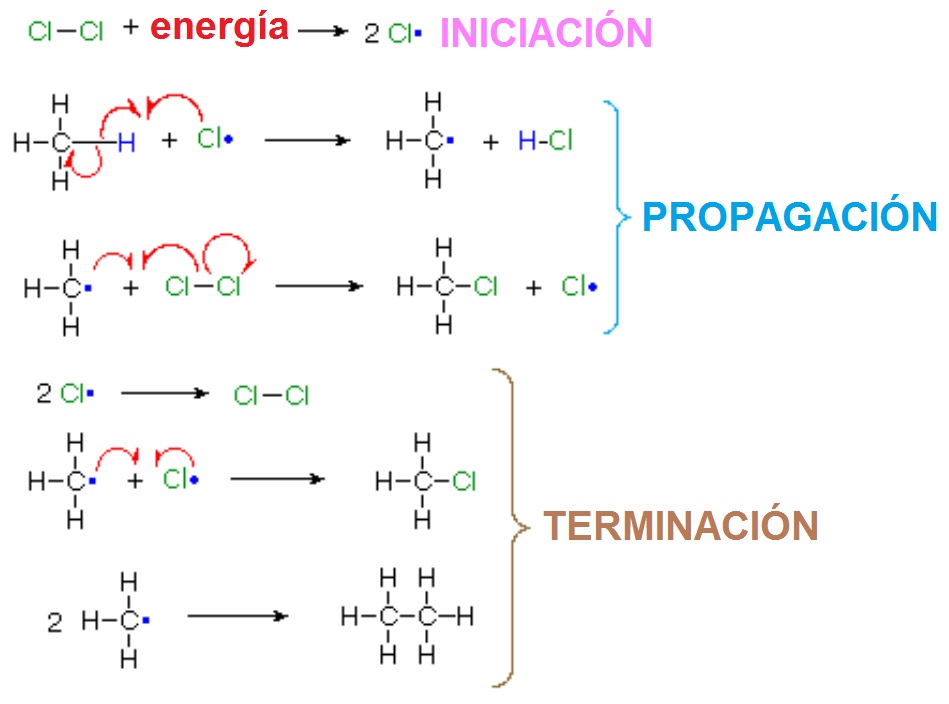
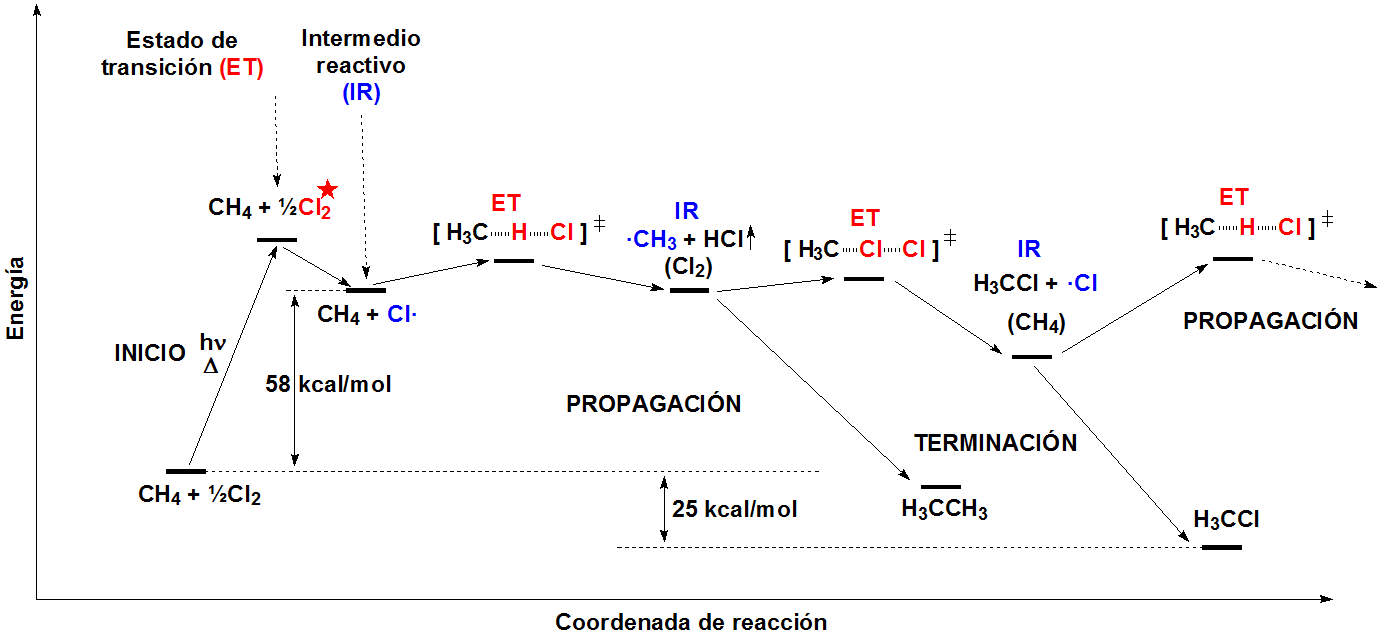
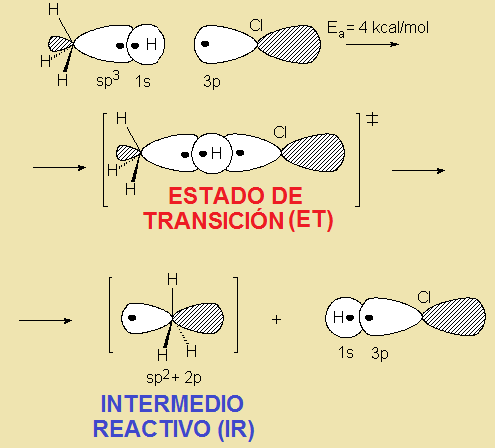
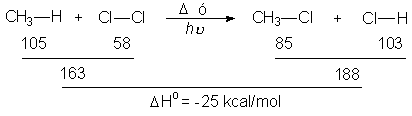En una secuencia de reacción, existen ESTADOS DE TRANSICIÓN, donde los enlaces están formándose y/o rompiéndose, e INTERMEDIOS REACTIVOS, que son especies transitorias, de energía elevada pero mínimos locales en el esquema general.
Conforme avanza una reacción los reactivos se acercan y, si se produce un choque efectivo, tiene lugar la ruptura y formación de enlaces. Esto es un proceso desfavorable ya que, a distancias suficientemente cortas, las moléculas se repelen. La energía potencial aumenta hasta que se alcanza una estructura de máxima energía o estado de transición (ET). La energía necesaria para llegar desde los reactivos al ET es la energía de activación, que es la que ocasiona que muchas reacciones exotérmicas no tengan lugar espontáneamente. Una vez superado el ET, el proceso puede dar lugar directamente a los productos o conducir a un intermedio reactivo (IR) que, a través de un nuevo ET, conduzca a los productos, o a un nuevo intermedio, éste a otro ET, y así sucesivamente. El mecanismo de una reacción es el recuento secuencial de cada uno de los ET e intermedios a través de los que transcurre. Los intermedios reactivos más importantes de las reacciones orgánicas son los radicales libres (R3C·), los carbocationes (R3C+), los carbaniones (R3C-) y los carbenos (R2C:).