CONFORMACIONES (ROTÁMEROS)
Los átomos unidos por un enlace sencillo giran uno respecto de otro con un coste de energía muy pequeño.
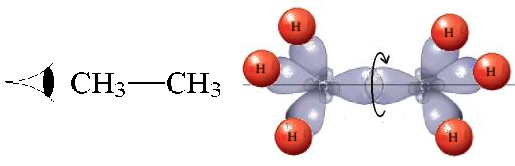
En el etano, el enlace C-C está formado por el solapamiento frontal de dos orbitales híbridos sp3. Utilicemos como eje la línea que une ambos carbonos enlazados. Se entiende bien de forma intuitiva que si giramos un orbital híbrido respecto del otro, a lo largo del eje mencionado y manteniendo los carbonos a la misma distancia, el solapamiento de los orbitales híbridos es siempre el mismo y el enlace, en principio, no sufre merma alguna.
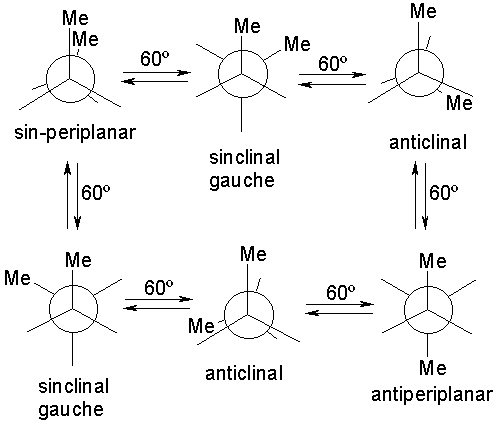
El número de posibles conformaciones (rotámeros) alrededor de un enlace sencillo es infinita pero podemos diferenciar dos posiciones significativas:
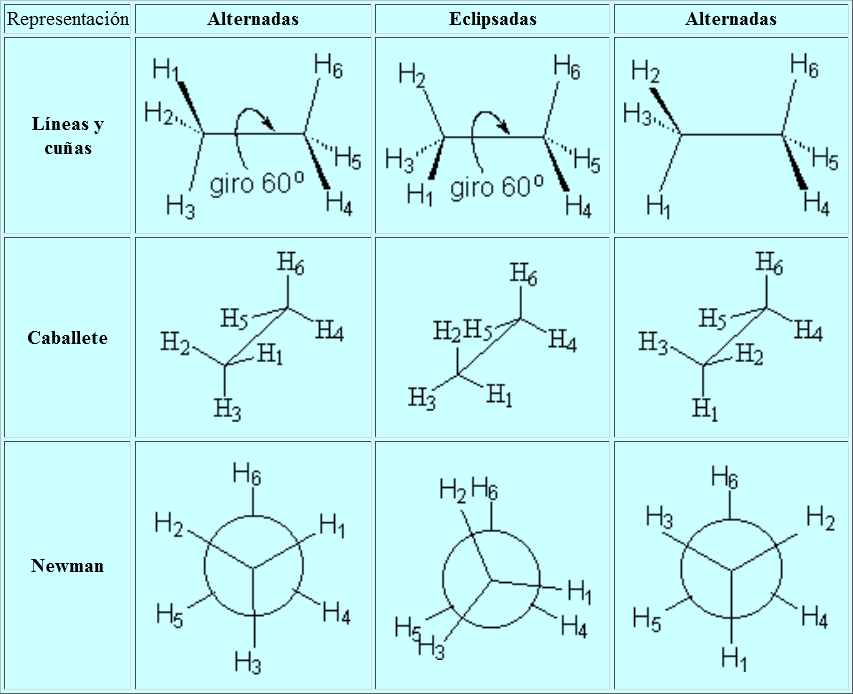
La forma de representar más cómoda y visualmente las conformaciones es mediante la PROYECCIÓN de NEWMAN
Melvin S. Newman (1908-1993): Profesor de la Universidad del Estado de Ohio en EEUU. Sus investigaciones se centraron en los efectos estéricos de moléculas conjestionadas. Hizo importantes contribuciones a la elucidación de mecanismos de reacción y de las propiedades quirales de numerosas moléculas. Su capacidad docente fue admirable y, entre otras cosas, ideó la famosa proyección que lleva su nombre para representar las conformaciones de compuestos orgánicos.
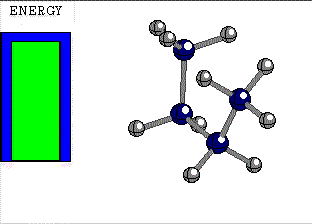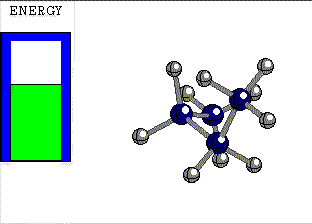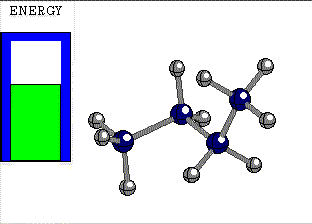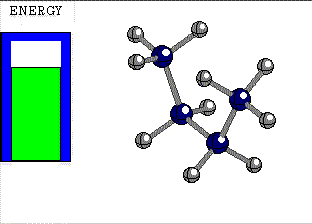
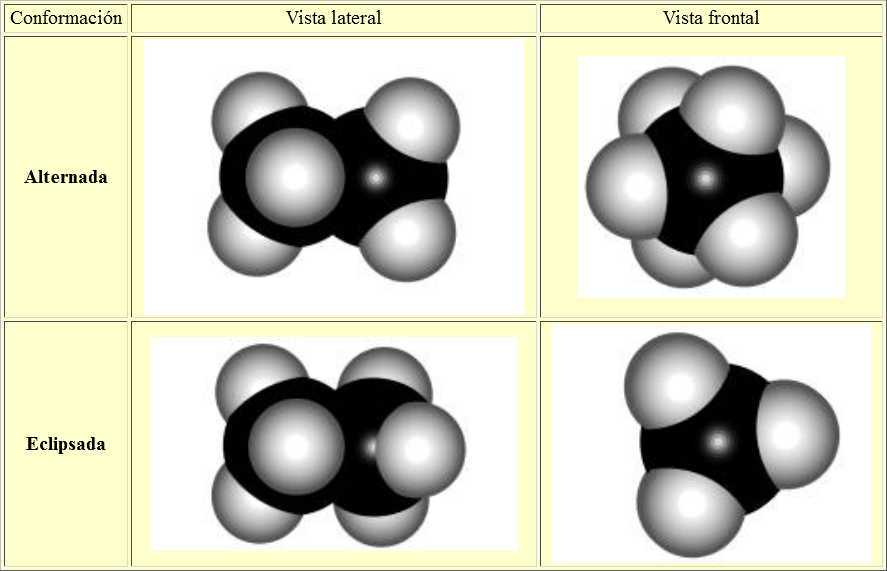
 ALTERNADA
ALTERNADA
 ECLIPSADA
ECLIPSADA
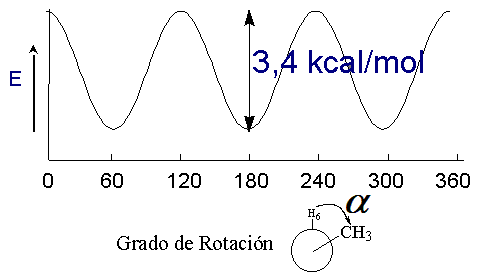
El giro de un enlace sencillo tiene un pequeño coste energético, cuya cuantía depende de los grupos unidos a los átomos que giran.
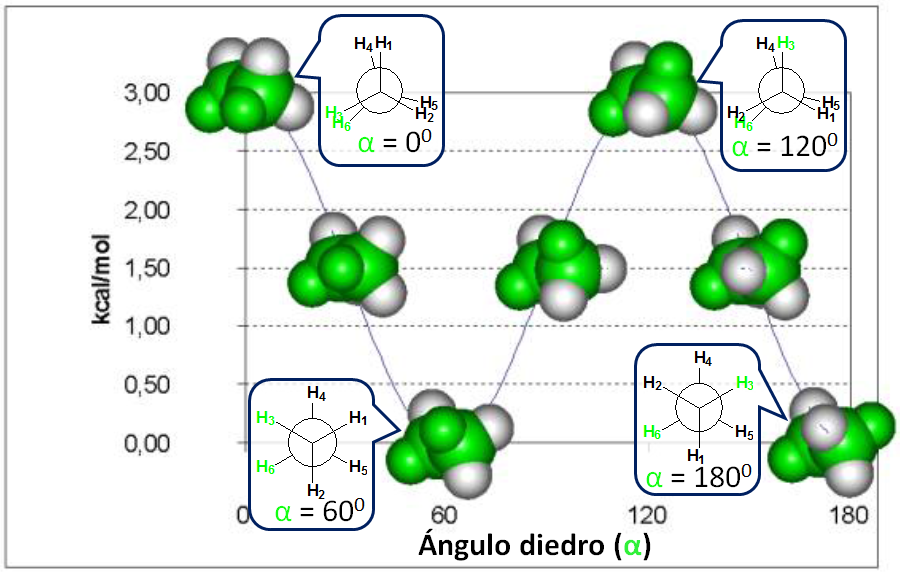
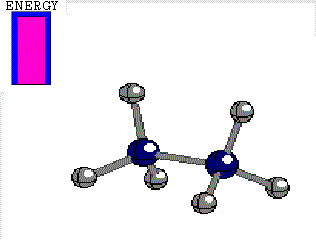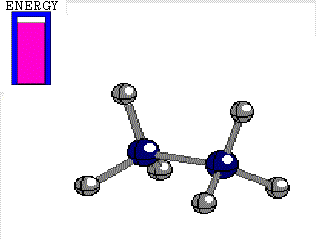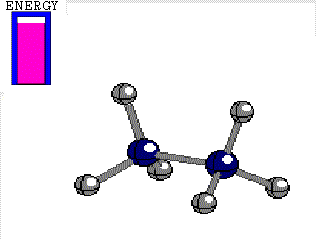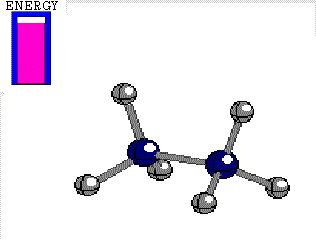 Diferencia de energía entre las conformaciones alternada y eclipsada del etano 3 kcal/mol
Diferencia de energía entre las conformaciones alternada y eclipsada del etano 3 kcal/mol
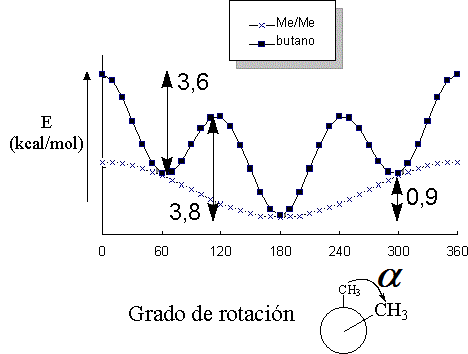
¿Cómo sería el perfil de energía frente al grado de rotación de un enlace C-C en el propano?. ¿Y el del enlace C-C central del butano?. Uno de los factores que genera la barrera de rotación del etano es la INTERACCIÓN ESTÉRICA desfavorable de los hidrógenos en la conformación eclipsada. Un grupo metilo tiene obviamente un mayor tamaño que un hidrógeno y su interacción estérica es logicamente mayor.
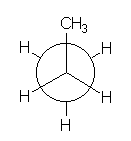 PROPANO
PROPANO
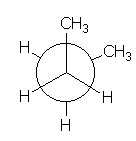 BUTANO
BUTANO
La diferencia energética que existe entre el mínimo de energía más bajo (conformación con los metilos antiperiplanares; 180º) y los otros mínimos locales (conformaciones con los metilos en gauche; 60º y 300º) es de 0.9 kcal/mol. Esta energía mide la interacción estérica desestabilizante que tiene lugar entre dos grupos Me en disposición gauche.
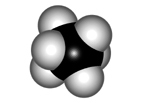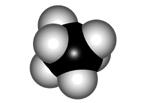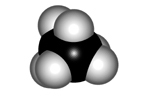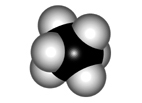

 ALTERNADA
ALTERNADA
 ECLIPSADA
ECLIPSADA
 Diferencia de energía entre las conformaciones alternada y eclipsada del etano 3 kcal/mol
Diferencia de energía entre las conformaciones alternada y eclipsada del etano 3 kcal/mol
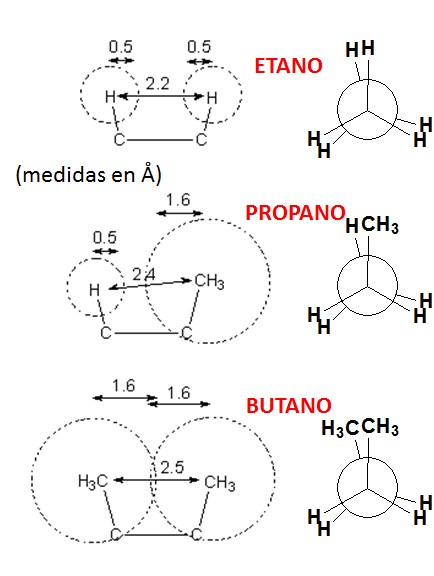
 PROPANO
PROPANO
 BUTANO
BUTANO