ESTABILIDAD RELATIVA DE CICLOALCANOS
La estabilidad relativa de los cicloalcanos depende de su tamaño y de la tensión que existe dentro de sus anillos.
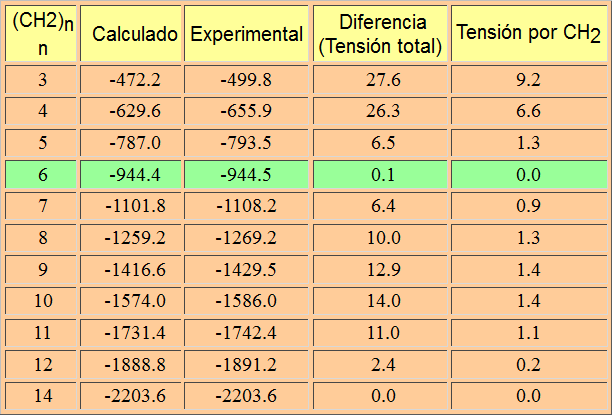
Observando la tabla de los calores de combustión de los alcanos puede deducirse que, por cada grupo CH2 añadido, el calor de combustión se hace más negativo por 157.4 kcal/mol. Podemos calcular así (157.4 x n) los calores de combustión de cicloalcanos (CH2)n.
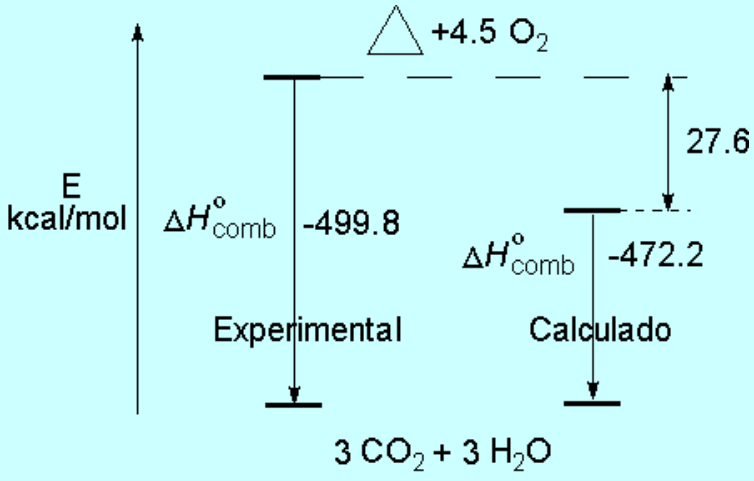
En el caso del ciclopropano la combustión es más exotérmica de lo esperado. Esto quiere decir que el ciclopropano no posee tres grupos CH2 "normales" sino que su disposición, formando el anillo de tres miembros, resulta más alta en energía (menos estable) de lo esperado. La diferencia de energía refleja la tensión que existe en el anillo de ciclopropano.
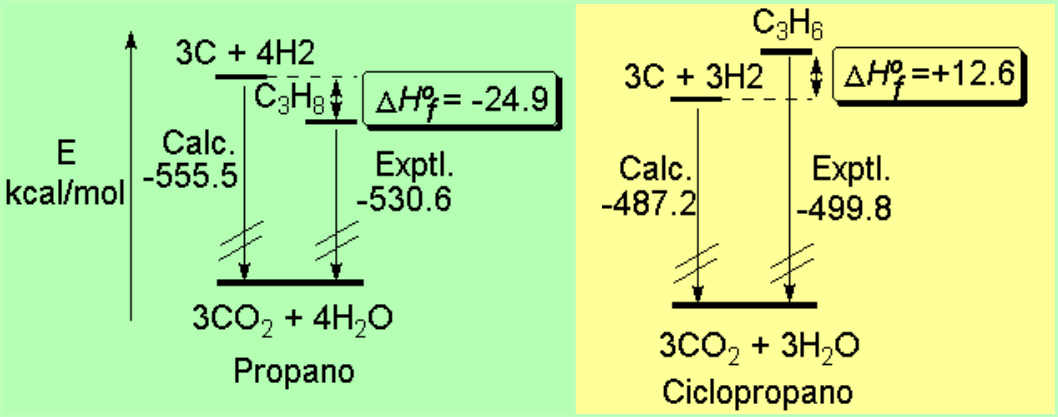
Podemos utilizar el cálculo de los calores de formación para comparar la estabilidad relativa del propano y ciclopropano
El propano es una situación más estable (por unas 25 kcal/mol) que sus elementos constituyentes por separado.
El ciclopropano es una situación menos estable (por unas 13 kcal/mol) que sus elementos constituyentes por separado. Esto no impide que el ciclopropano exista y sea una molécula estable pero el calor de formación positivo refleja de nuevo la existencia de tensión en el anillo. Esto hará que sea más reactiva y trate de liberar la tensión mediante la apertura del anillo.
Los cicloalcanos pequeños son más inestables de lo que cabía esperar considerándolos como alcanos “normales”. ¿Cuál es el origen de esa anormalidad?
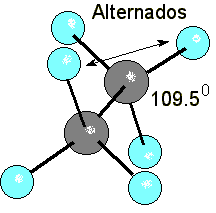
En un alcano acíclico el solapamiento frontal de los orbitales híbridos sp3 es máximo, dando lugar a un enlace C-C de gran fortaleza (deltaHºC-C = 90 kcal/mol). Por otra parte, los hidrógenos pueden adoptar una conformación alternada donde minimicen sus interacciones estéricas y orbitálicas.
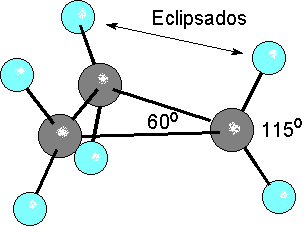
 El ángulo interno del ciclopropano es de 60º, mucho más pequeño que el ángulo natural de los híbridos sp3 (109.5º). Por tanto el solapamiento no puede ser frontal y es más imperfecto. Esto se demuestra experimentalmente porque el enlace C-C es mucho más débil en el ciclopropano (deltaHºC-C = 65 kcal/mol) que en un alcano acíclico.
El ángulo interno del ciclopropano es de 60º, mucho más pequeño que el ángulo natural de los híbridos sp3 (109.5º). Por tanto el solapamiento no puede ser frontal y es más imperfecto. Esto se demuestra experimentalmente porque el enlace C-C es mucho más débil en el ciclopropano (deltaHºC-C = 65 kcal/mol) que en un alcano acíclico.
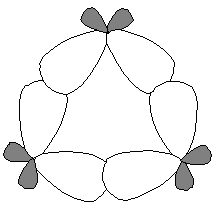
 Además de la distorsión en el solapamiento de los orbitales híbridos debido al pequeño tamaño del anillo, los hidrógenos de carbonos contiguos están inevitablemente eclipsados. Esto confiere una inestabilidad añadida a la molécula. El conjunto de estos dos factores (tensión de anillo y tensión de eclipsamiento) permite explicar la diferencia entre el calor de combustión calculado, como si fuera un alcano acíclico, y el experimental.
Además de la distorsión en el solapamiento de los orbitales híbridos debido al pequeño tamaño del anillo, los hidrógenos de carbonos contiguos están inevitablemente eclipsados. Esto confiere una inestabilidad añadida a la molécula. El conjunto de estos dos factores (tensión de anillo y tensión de eclipsamiento) permite explicar la diferencia entre el calor de combustión calculado, como si fuera un alcano acíclico, y el experimental.
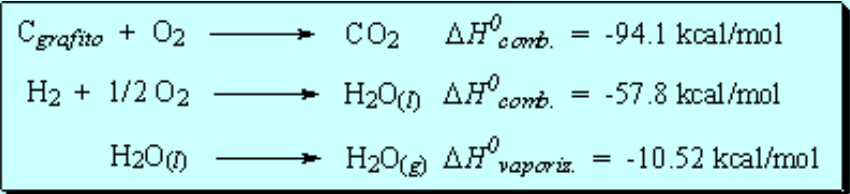
 El ángulo interno del ciclopropano es de 60º, mucho más pequeño que el ángulo natural de los híbridos sp3 (109.5º). Por tanto el solapamiento no puede ser frontal y es más imperfecto. Esto se demuestra experimentalmente porque el enlace C-C es mucho más débil en el ciclopropano (deltaHºC-C = 65 kcal/mol) que en un alcano acíclico.
El ángulo interno del ciclopropano es de 60º, mucho más pequeño que el ángulo natural de los híbridos sp3 (109.5º). Por tanto el solapamiento no puede ser frontal y es más imperfecto. Esto se demuestra experimentalmente porque el enlace C-C es mucho más débil en el ciclopropano (deltaHºC-C = 65 kcal/mol) que en un alcano acíclico. Además de la distorsión en el solapamiento de los orbitales híbridos debido al pequeño tamaño del anillo, los hidrógenos de carbonos contiguos están inevitablemente eclipsados. Esto confiere una inestabilidad añadida a la molécula. El conjunto de estos dos factores (tensión de anillo y tensión de eclipsamiento) permite explicar la diferencia entre el calor de combustión calculado, como si fuera un alcano acíclico, y el experimental.
Además de la distorsión en el solapamiento de los orbitales híbridos debido al pequeño tamaño del anillo, los hidrógenos de carbonos contiguos están inevitablemente eclipsados. Esto confiere una inestabilidad añadida a la molécula. El conjunto de estos dos factores (tensión de anillo y tensión de eclipsamiento) permite explicar la diferencia entre el calor de combustión calculado, como si fuera un alcano acíclico, y el experimental.