(IN)ESTABILIDAD DE RADICALES
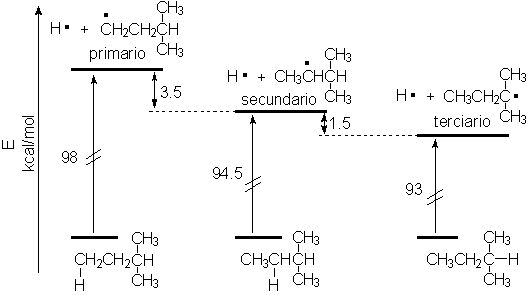
Los radicales libres, formados por ruptura homolítica de un enlace C-H en alcanos, son intermedios reactivos cuya (in)estabilidad depende de su estructura terciaria (menos inestable), secundaria o primaria.
Mira los datos experimentales siguientes ¿Qué se puede deducir de ellos? Muchas cosas... 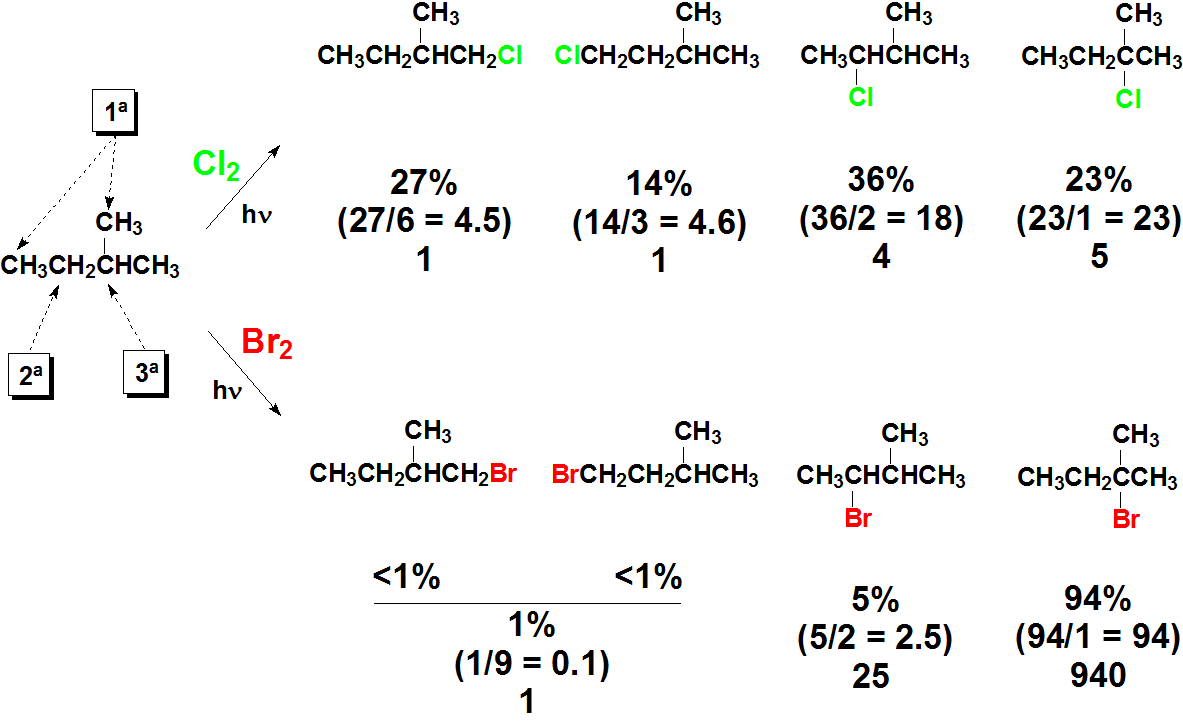
- Se obtienen mezclas de compuestos
- Las posiciones primaria (dos tipos), secundaria y terciaria no reaccionan en igualdad de condiciones
- La reacción con el Br2 es mucho más selectiva
- La posición terciaria es la más reactiva, seguida de la secundaria y la menos, la primaria.
Gracias a estos datos se ha podido medir experimentalmente que la fortaleza de los enlaces C-H no es siempre la misma y que depende de la estructura.
Los datos experimentales nos permiten deducir que los radicales son tanto menos inestables cuanto mayor es la sustitución del carbono donde se producen. Pero, ¿hay alguna razón teórica que nos permita explicar este comportamiento?.
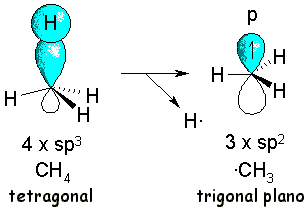
Mediante técnicas experimentales muy sofisticadas se puede comprobar que el radical metilo tiene una geometría trigonal plana. Por tanto, la ruptura de un enlace C-H en el metano debe producir un cambio de hibridación en el carbono, de sp3 a sp2, y el electrón desapareado reside en un orbital p.
El carbono central del radical ·CH3 es deficiente en electrones porque no tiene el octete completo. En el radical metilo la historia se acaba aquí. Pero, si el radical fuera más complejo, existen posibilidades de importar densidad electrónica desde otros átomos con lo que se disminuirá la inestabilidad propia del radical.
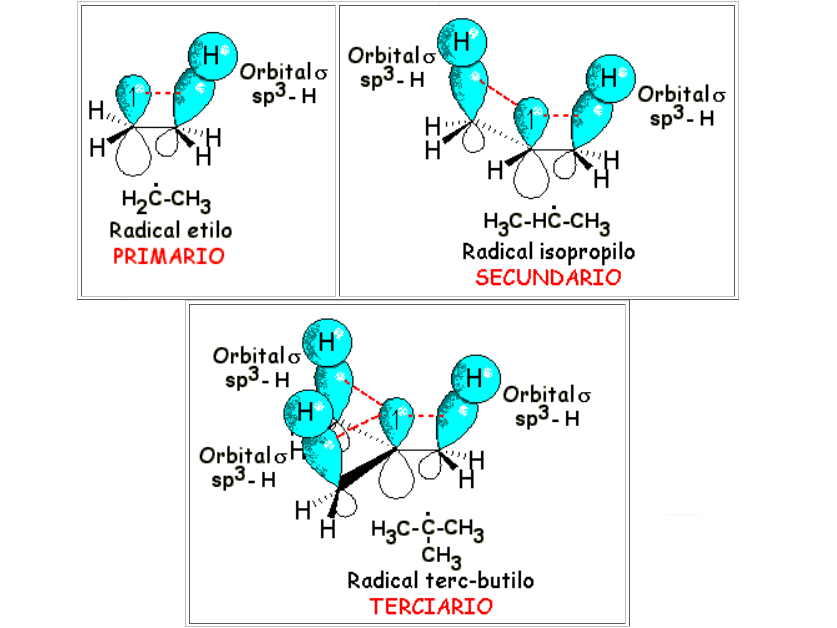
Los orbitales sigma enlazantes vecinos al orbital p que contiene el electrón desapareado pueden dar lugar a un solapamiento lateral distorsionado (parecido al de un enlace pi pero mucho menos efectivo) y deslocalizar así el defecto de densidad electrónica. Cuantos más enlaces sigma haya alrededor del centro radicalario, mayor será la estabilización. De esta forma tan sencilla entendemos por qué un radical terciario es el menos inestable.