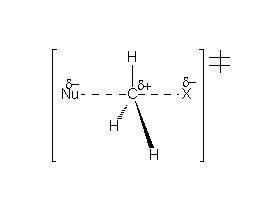El ET tiene un desarrollo de cargas mínimo y no se favorece especialmente por la polaridad del disolvente.
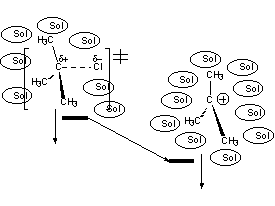
Sin embargo, el nucleófilo puede estar solvatado por un disolvente polar y dificultarse el mecanismo SN2.
La presencia de grupos salientes buenos favorece el mecanismo SN2.
La fortaleza del nucleófilo favorece la velocidad del mecanismo SN2.
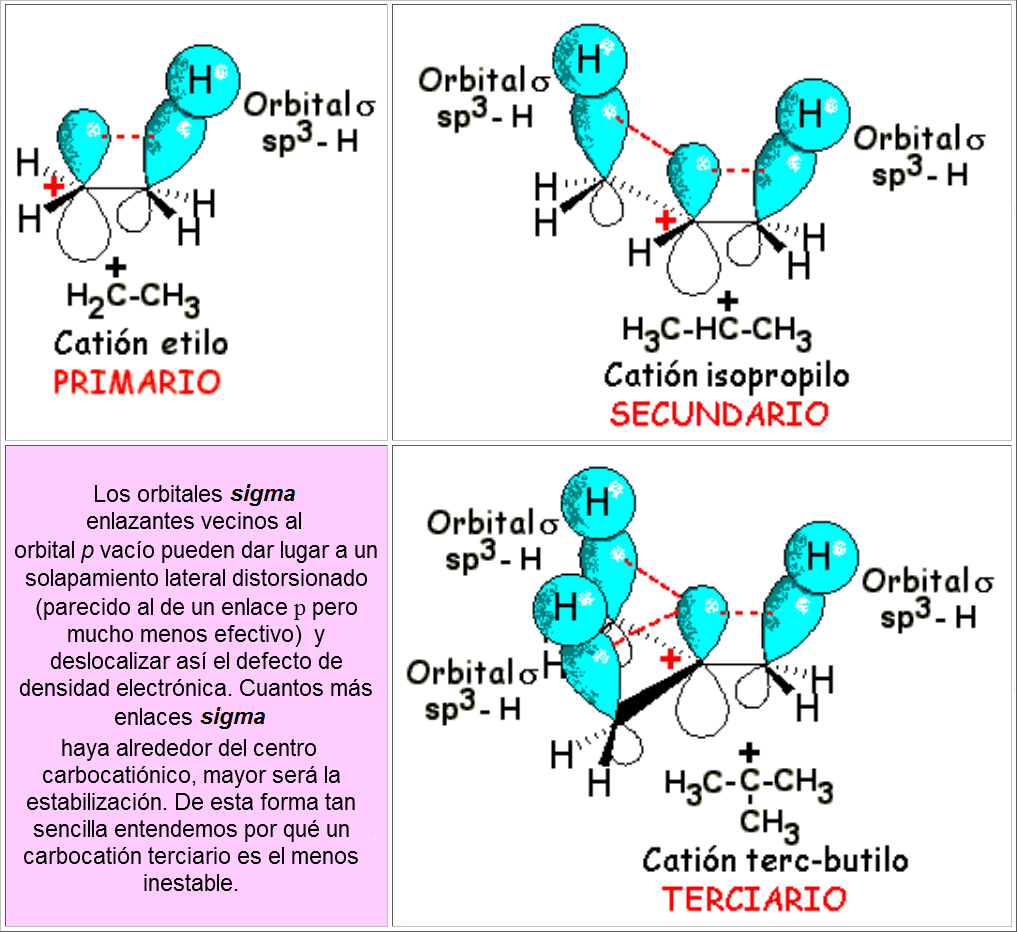
La sustitución en el carbono reaccionante impide el mecanismo SN2.
El intermedio carbocatión tiene una carga neta y se estabiliza por solvatación. En el ET la carga está bastante desarrollada (se parece más al carbocatión que a los reactivos) y ya disfruta de esta estabilización parcialmente.
La presencia de grupos salientes buenos favorece el mecanismo SN1.
La fortaleza del nucleófilo no afecta a la velocidad del mecanismo SN1.
La sustitución en el carbono reaccionante favorece el mecanismo SN1.
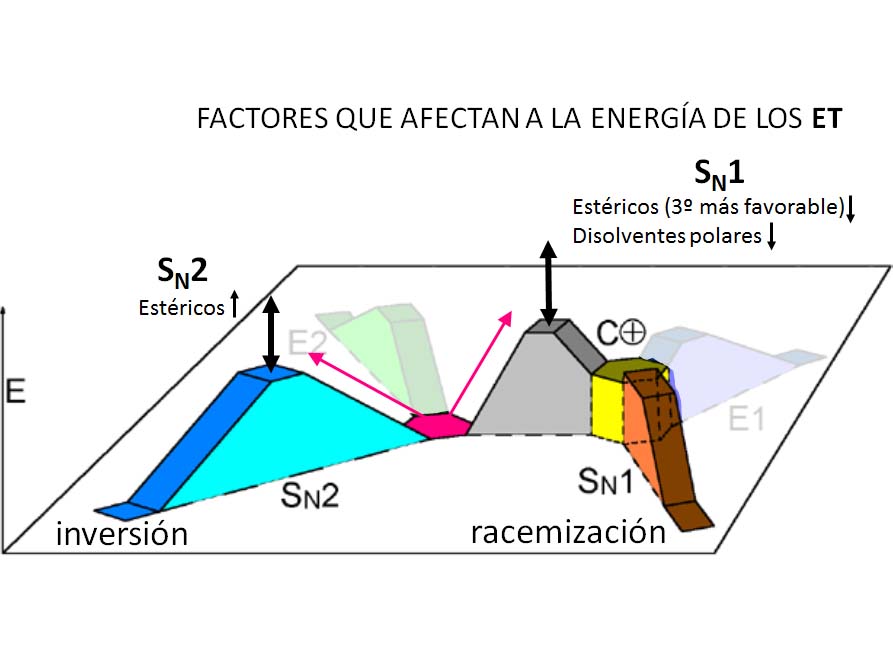
La proporción de moléculas que reaccionarán según los mecanismos SN1 ó SN2, con las implicaciones estereoquímicas que ello conlleva (racemización o inversión), depende de su estructura:
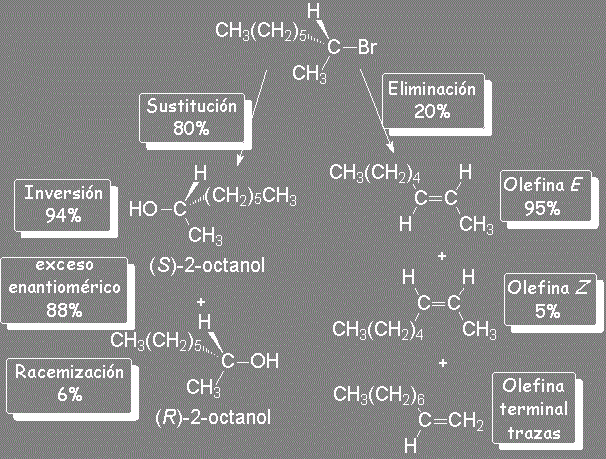
Volvamos a nuestro experimento. Recordemos que el (R)-2-bromooctano daba lugar a un 80% de alcohol. De él, el 94% es de configuración S y el 6% R.
Ahora podemos decir que el 88% del (S)-2-octanol proviene de un mecanismo SN2.
Un 6% de isómero S y el 6% de isómero R se produce por racemización a través de un mecanismo SN1.
Pero, ¿y las olefinas? ¿Cómo se han producido?