ADICIÓN DE HALUROS DE HIDRÓGENO A ALQUENOS
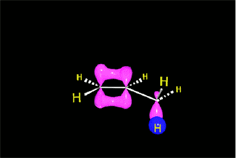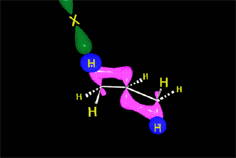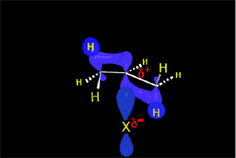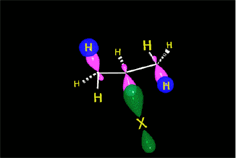
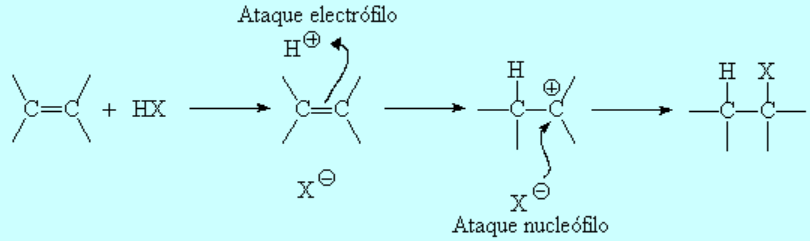
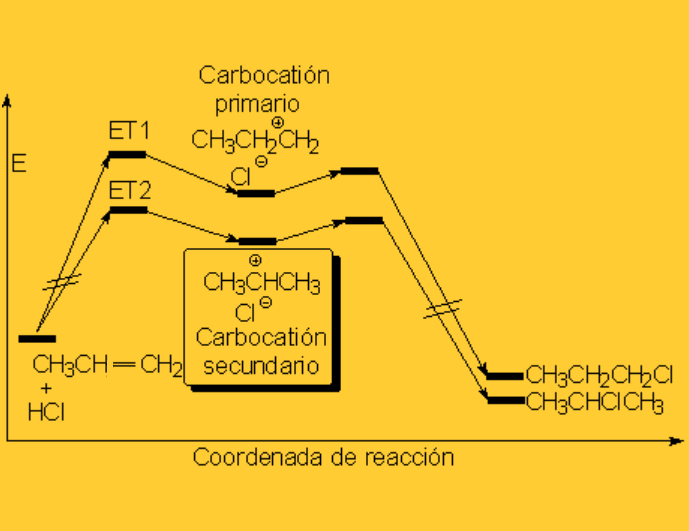
Los haluros de hidrógeno sufren ruptura heterolítica con facilidad. El protón resultante es fuertemente electrófilo y es "admitido" por el doble enlace, formándose un carbocatión (¡el menos inestable posible!), con el que colapsa el anión haluro.
Cualquiera de los cuatro haluros de hidrógeno (HI, HBr, HCl ó HF) da la reacción que es regioselectiva: El producto formado depende de la estabilidad relativa de los carbocationes intermedios.
La protonación inicial de la olefina se produce de forma que se obtenga el carbocatión menos inestable.
Mucho antes de que los químicos supieran lo que era un carbocation, Markovnikov estableció su famosa regla.
Regla de Markovnikov: El protón del haluro de hidrógeno se une al carbono menos sustituído.
 Vladimir Vasilyevich Markovnikov, o también Markownikoff, (Diciembre 22, 1838 – Febrero 11, 1904), fue un químico ruso.
Vladimir Vasilyevich Markovnikov, o también Markownikoff, (Diciembre 22, 1838 – Febrero 11, 1904), fue un químico ruso.
Pero, ¿qué ocurre si en el medio de reacción agregamos un peróxido?
La regioquímica de la reacción cambia. El mecanismo debe ser, por tanto, diferente:
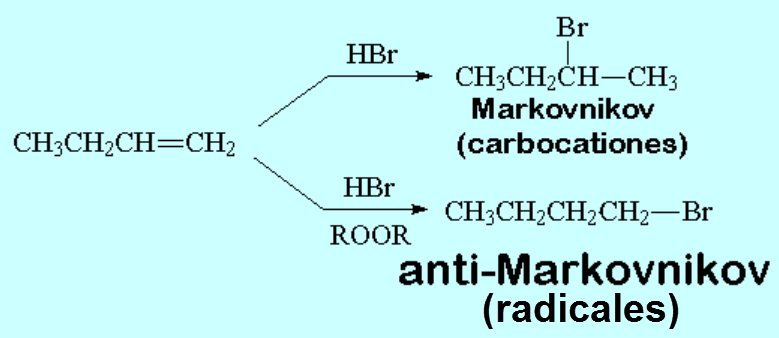
Considera que el atacante es ahora un radical halógeno... ¿Entiendes por qué la regioquímica de la reacción cambia?
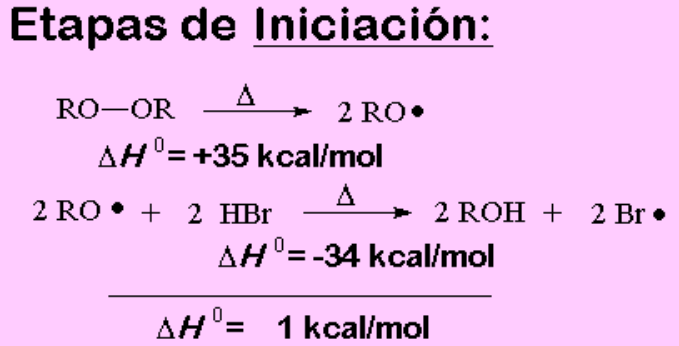
Al adicionar peróxido el mecanismo transcurre a través de radicales y no de carbocaiones:
El peróxido se escinde homolíticamente en dos radicales oxialquilo. Estos reaccionan rápidamente abstrayendo un hidrógeno del HBr, produciendo radicales bromo Br·
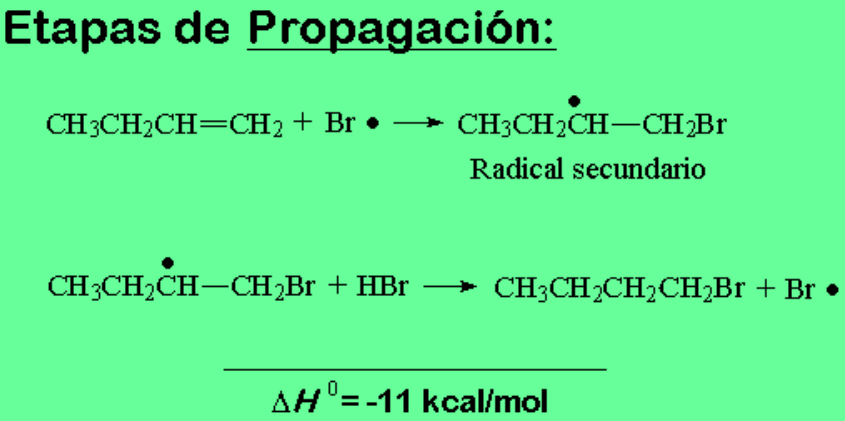
El Br·, ¡NO el H·! ataca a la olefina dando el radical C· secundario menos inestable.
Esta es la clave de la diferente regioquímica:
sin peróxidos el atacante es el H+ y la reacción transcurre por carbocationes; con peróxidos el atacante es el Br· y la reacción transcurre via radicales.
En ambos casos la reacción discurre por el camino de menor energía.
 Vladimir Vasilyevich Markovnikov, o también Markownikoff, (Diciembre 22, 1838 – Febrero 11, 1904), fue un químico ruso.
Vladimir Vasilyevich Markovnikov, o también Markownikoff, (Diciembre 22, 1838 – Febrero 11, 1904), fue un químico ruso.