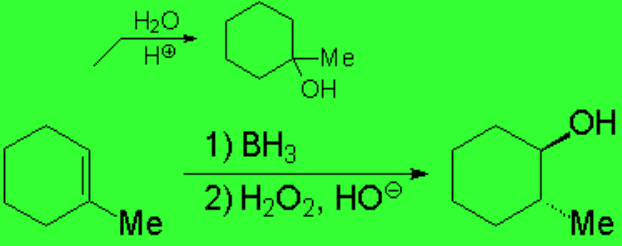
HIDROBORACIÓN-OXIDACIÓN DE ALQUENOS
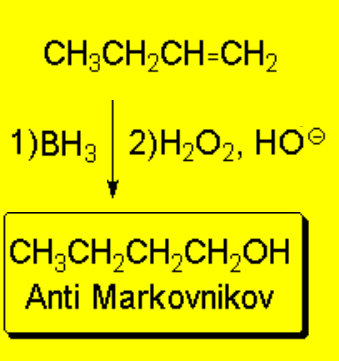
La hidroboración de olefinas, seguida de oxidación, permite obtener alcoholes con regioquímica anti-Markovnikov.
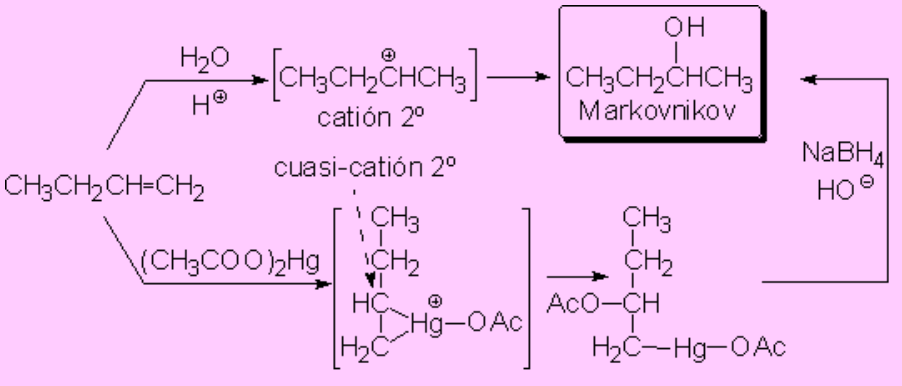
La adición a olefinas de agua en medio ácido o la reacción de oximercuriación-demercuriación proceden por medio de carbocationes o cuasi-carbocationes, respectivamente, por lo que la regioquímica de estas reacciones es Markovnikov.
Así que, si la hidroboración-oxidación produce alcoholes anti-Markovnikov, es que debe transcurrir por un mecanismo completamente distinto, sin el concurso de carbocationes:
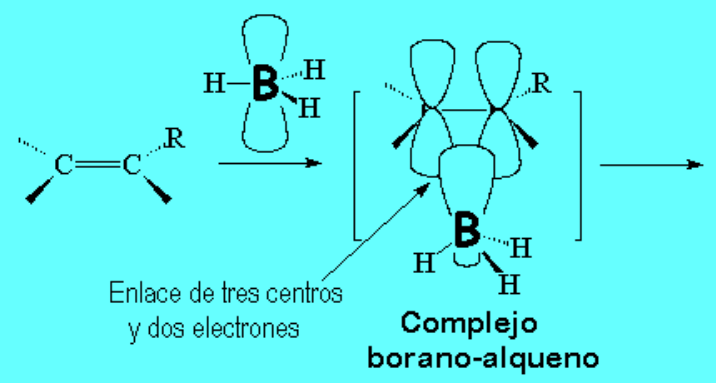
El primer paso es simplemente una reacción ácido-base de Lewis, entre el boro del borano, que tiene el octete incompleto y es electrófilo, y la nube "pi" de la olefina, rica en electrones.
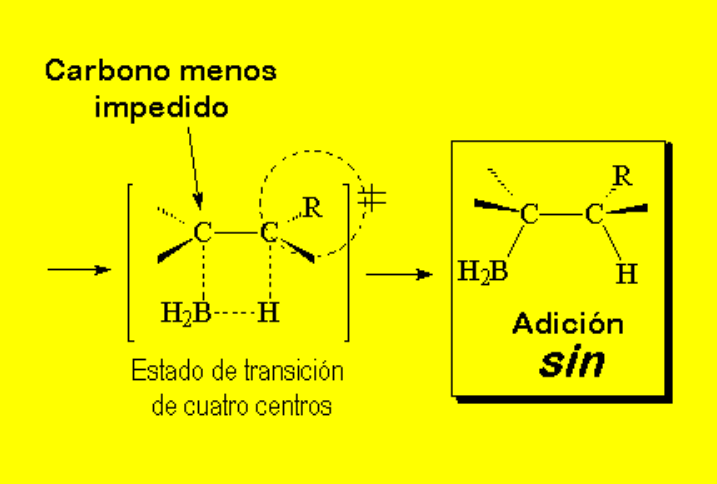
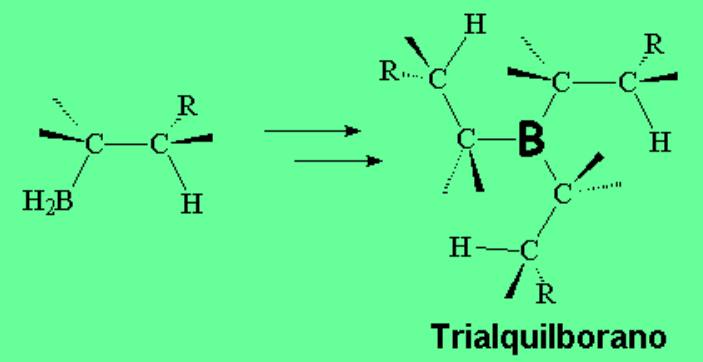
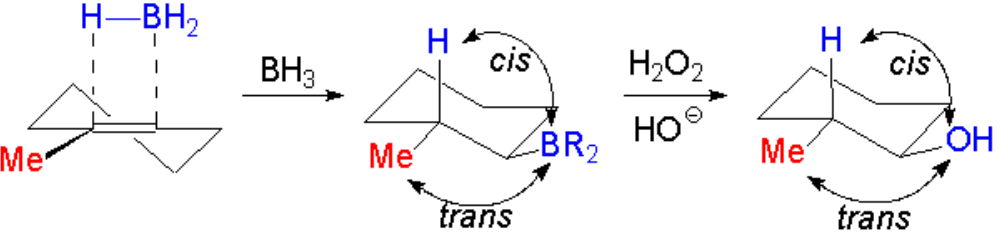
En el segundo paso el complejo borano-alqueno se rompe por desplazamiento del boro hacia el carbono menos sustituído (menos impedido). Esta es la clave de la obtención del alcohol anti-Markovnikov, ya que en la etapa de oxidación el boro será reemplazado por un grupo OH.
Una vez formado el alquilborano, el boro vuelve a tener el octete incompleto y puede reaccionar con otros dos moles de olefina.
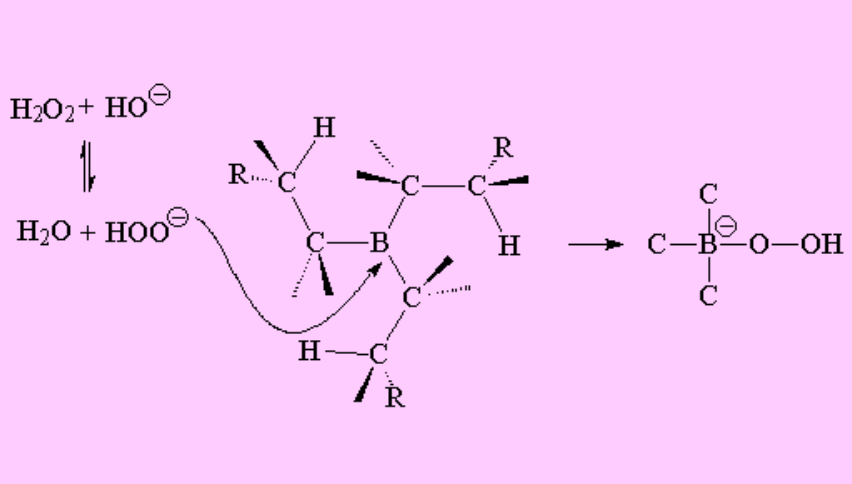
Los siguientes pasos pertenecen a la oxidación del trialquilborano, que se efectúa con agua oxigenada en medio básico.
En el trialquilborano el boro sigue teniendo el octete imcompleto pero ya no posee hidrógenos para adicionarse a otra olefina. Sin embargo, puede admitir electrones del agua oxigenada desprotonada por el hidróxido.
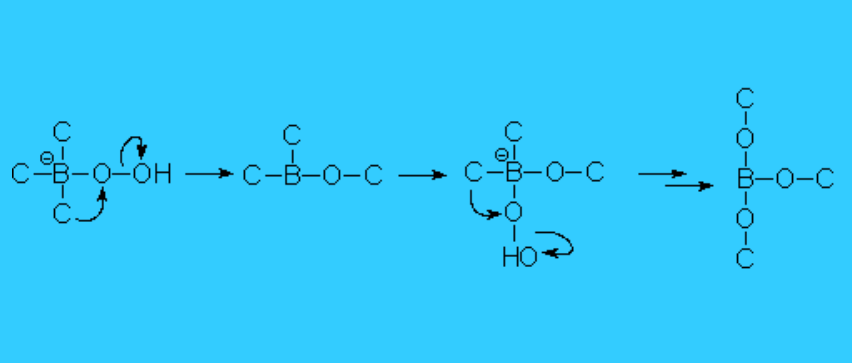
Se produce entonces una transposición del carbono desde el boro al oxígeno, con pérdida de hidróxido, que se recupera. La debilidad del enlace O-O posibilita el movimiento del carbono
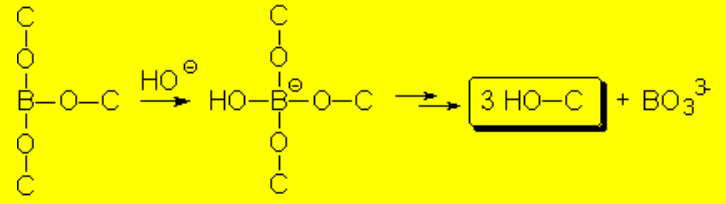
El alcoxiborano se hidroliza en el medio básico para dar el alcohol y borato.
La reacción es, por tanto, regioselectiva y estereoespecífica:
La regioquímica es anti-Markovnikov y la estereoquímica de adición es sin. Por ello el OH y el Me están en trans.
El boro es reemplazado por el OH con retención de la configuración