 |
|
La cara de la olefina que está en el lado opuesto al anillo de ciclopropano es la única que puede acercarse a la superficie del catalizador sin impedimento. Por tanto la hidrogenación se produce solamente por esta cara, obteniéndose el cis-carano, producto relativamente inestable, porque posee una interacción entre los metilos indicados. El trans-carano, que debe ser más estable porque carece de interacciones entre los metilos, no puede obtenerse porque la aproximación adecuada del careno al catalizador está fuertemente impedida por uno de los grupos metilo del ciclopropano.
El diagrama cualitativo de energía de la reacción debe ser:
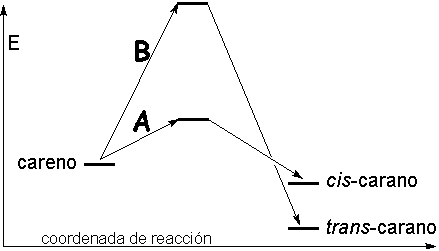 |
El camino B posee una energía de activación tan alta que transcurre a una velocidad insignificante, a pesar de que conduce al producto trans más estable.
La presencia del anillo de ciclopropano, que en su fusión
con el anillo de ciclohexano forma dos estereocentros de configuración
definida, ocasiona que las dos caras del doble enlace tengan entornos estéricos
muy diferentes. La diferencia es tan grande en el caso del careno y la
molécula es tan rígida que el hidrógeno sólo
se adiciona por una cara, dando lugar a una caso de total selectividad
facial en la adición a un doble enlace.