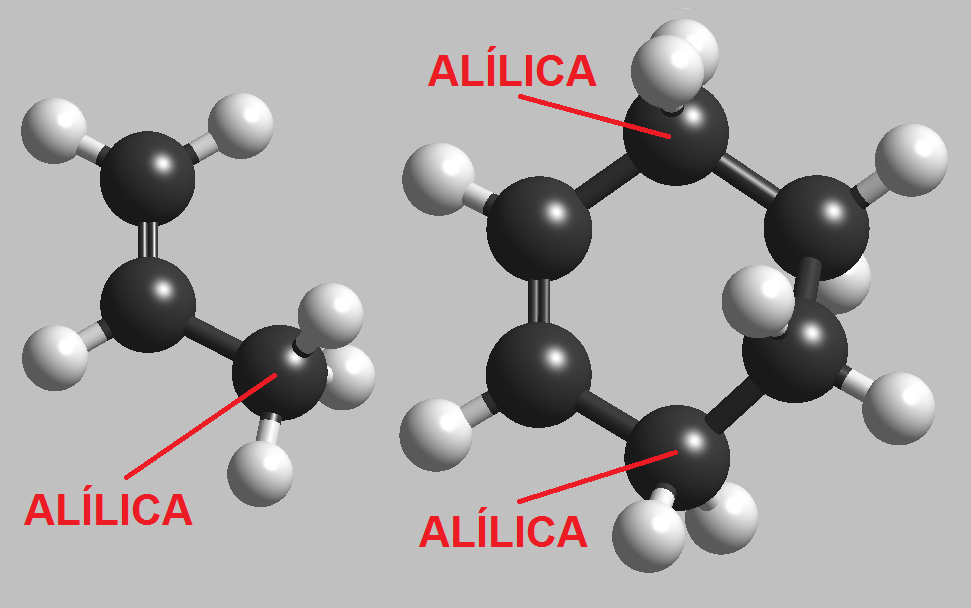
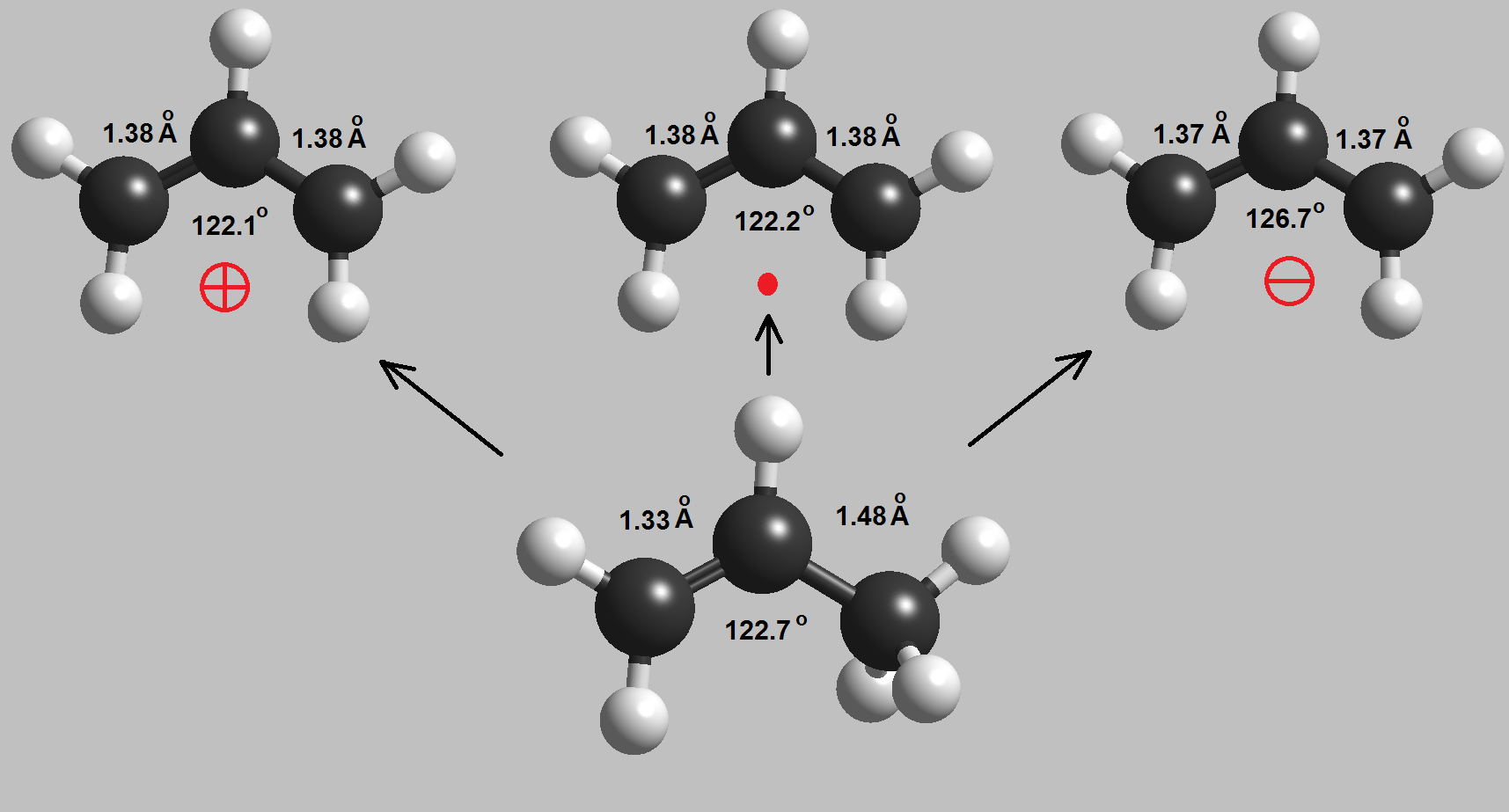
La posición denominada alílica está situada en el carbono contiguo a un doble enlace. El propeno es la molécula más pequeña que contiene una posición alílica. En el ciclohexeno hay dos posiciones alílicas equivalentes.
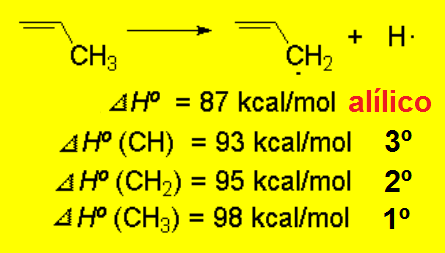
Hasta ahora una posición 3ª era la más ventajosa para disponer una carga positiva o un radical.
La posición alílica lo es todavía más. La fortaleza del enlace C-H es menor en la posición alílica porque un radical alílico es el menos inestable.
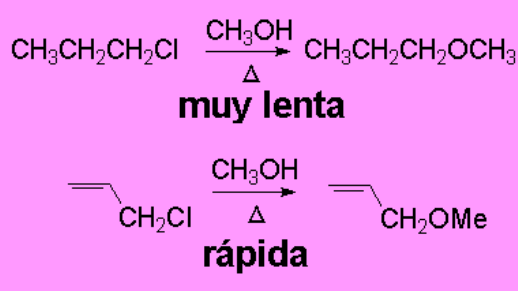
La metanolisis del 1-cloropropano es muy lenta porque el metanol es un nucleófilo relativamente pobre y la ruptura heterolítica del enlace C-Cl no está favorecida porque se obtiene un carbocatión 1º, que es el más inestable. Sin embargo, la reacción en las mismas condiciones sobre el cloruro de 2-propenilo es mucho más rápida.
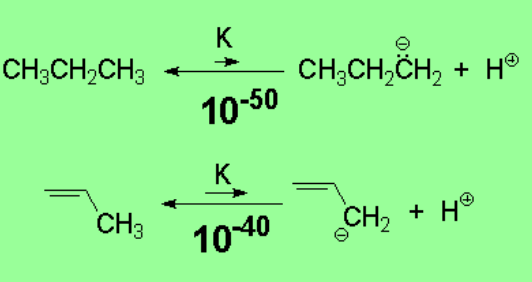
Los alcanos tienen una acidez extraordinariamente pequeña. La ruptura heterolítica de un enlace C-H en un alcano tiene un coste energético muy elevado. Se forma un carbanión muy inestable.
Aunque el propeno tiene también una acidez muy pequeña, la posición alílica es diez órdenes de magnitud más ácida. Esto sugiere que el carbanión alílico es menos inestable de lo esperado.
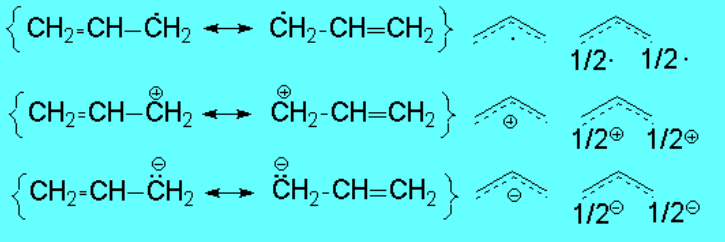
Estos hechos experimentales nos indican que la producción de un radical, catión o anión en posición alílica es algo menos difícil de lo esperado. El doble enlace contiguo es capaz de estabilizar por resonancia la especie generada. Escribamos las formas resonantes:
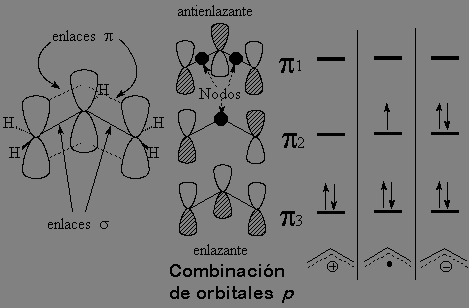
Las formas resonantes nos indican que el doble enlace deslocaliza la especie generada. Un sencillo diagrama de orbitales moleculares nos permite entender este hecho:
Los tres carbonos de un radical, catión o anión alílico poseen hibridación sp2. Los orbitales p restantes en cada carbono solapan dando lugar a tres orbitales moleculares donde los electrones pueden residir con cierta estabilidad. Esto no es posible sin la presencia del doble enlace.