SEAr DE COMPUESTOS AROMÁTICOS POLICÍCLICOS
Los hidrocarburos aromáticos policíclicos sufren las mismas reacciones de sustitución electrófila que el benceno. Pero hay algunos detalles nuevos.
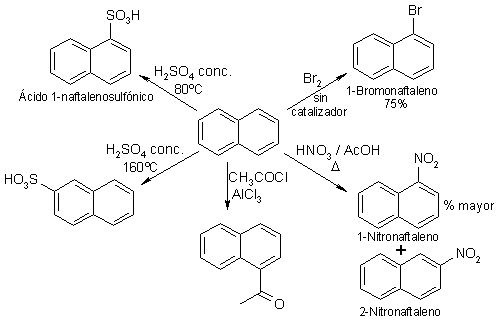
El naftaleno es más reactivo que el benceno.
Por ejemplo, la bromación no necesita de catalizador y la nitración se puede llevar a cabo con ácido acético, mucho más débil que el ácido sulfúrico.
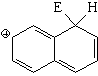
La posición 1 es la más reactiva del naftaleno.
Puede verse que, a excepción de la sulfonación a alta temperatura, la posición atacada es siempre la 1 (alfa).
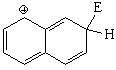
La descripción de los intermedios de reacción con formas resonantes permite explicar fácilmente por qué la posición 1 es la más reactiva.
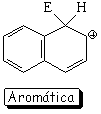
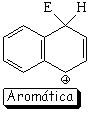
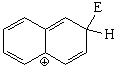
Sustitución en la posición 1 (alfa)
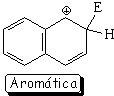
El híbrido de resonancia del intermedio de la sustitución en posición 1 es más aromático y, por tanto, menos inestable porque tiene dos formas resonantes que mantienen la aromaticidad de un anillo
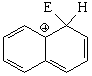
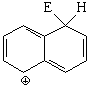
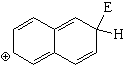
Sustitución en la posición 2 (beta)
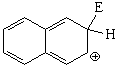
El híbrido de resonancia del intermedio de la sustitución en posición 2 es menos aromático y, por tanto, más inestable porque tiene una sóla forma resonante que mantiene la aromaticidad de un anillo
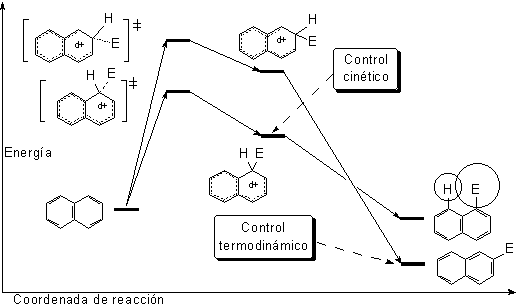
Pero, paradójicamente, la sustitución en 1 (alfa) da lugar al producto más congestionado estéricamente y, por tanto, menos estable.
El camino de la sustitución en 1 (alfa) resulta así más bajo en energía, porque el intermedio correspondiente es menos inestable.
El producto de sustitución en 1 (alfa) se obtiene más rápidamente (control cinético). Sin embargo, en el caso de la sulfonación, que es reversible, si la reacción se prolonga en el tiempo y con una temperatura elevada, el producto que se obtiene es el de sutitución en 2 (beta; control termodinámico).
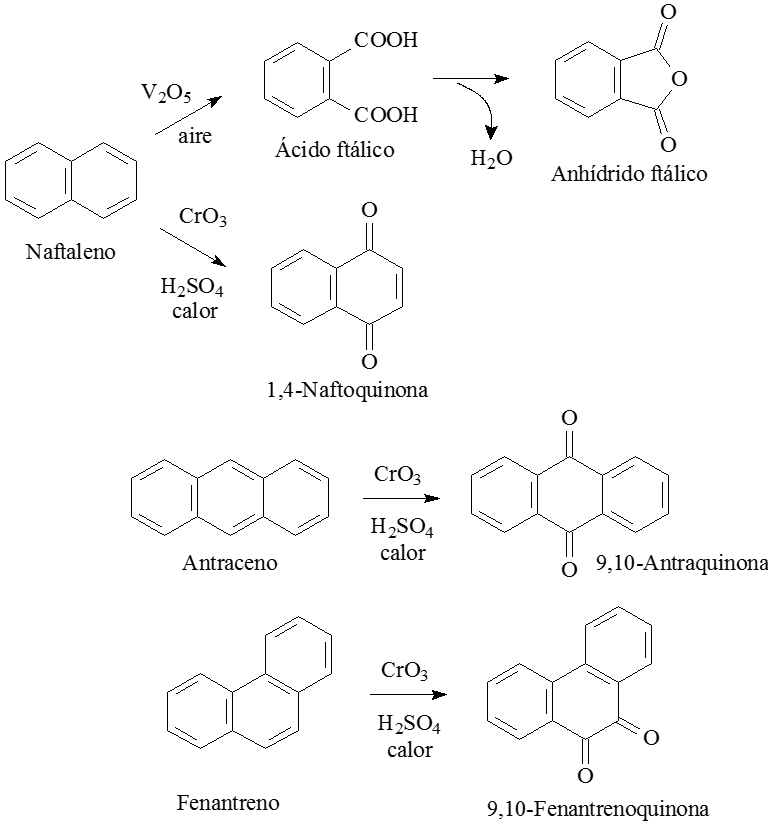
Los hidrocarburos aromáticos policíclicos "pueden permitirse" sufrir reacciones de oxidación y reducción a expensas de consumir la aromaticidad de algún anillo.
OXIDACIÓN
La oxidación enérgica del naftaleno produce la ruptura de uno de los anillos. La oxidación suave da lugar a naftoquinona.
La oxidación del antraceno se produce en el anillo central, para preservar el máximo grado de aromaticidad en los anillos extremos.
El fenantreno también se oxida en el anillo central por la misma razón.
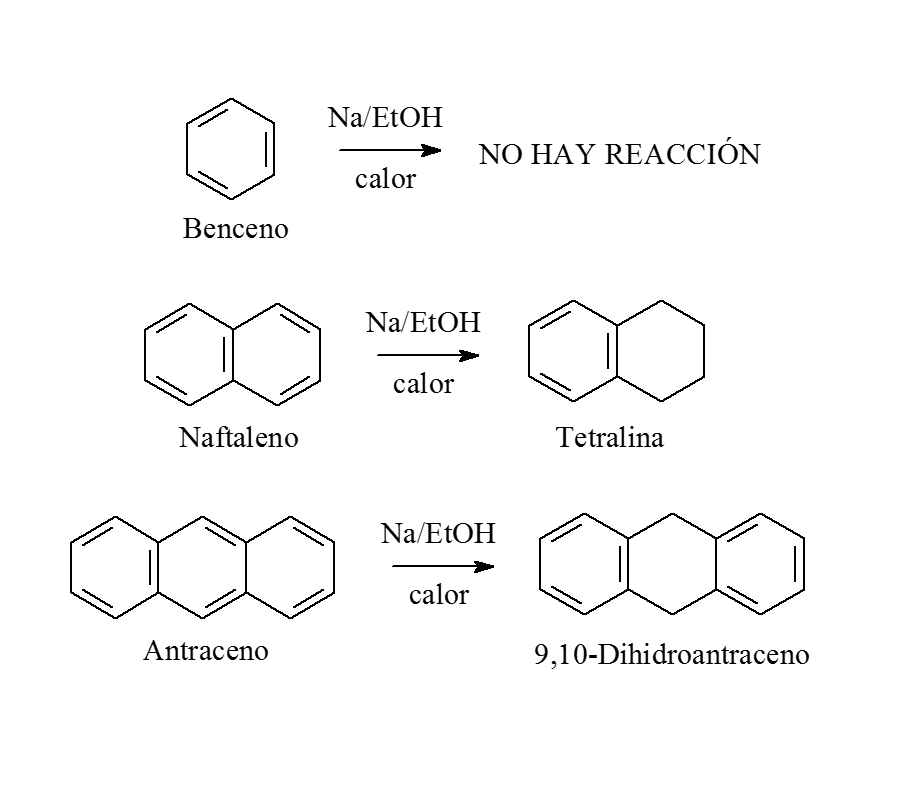
REDUCCIÓN
En condiciones en las que el benceno no se reduce en absoluto, el naftaleno es capaz de aceptar cuatro electrones desde el sodio.
El tetrahidronaftaleno resultante (tetralina) aún conserva la aromaticidad de una anillo.
El antraceno acepta dos electrones y el anillo central se reduce, conservándose la aromaticidad de dos anillos.