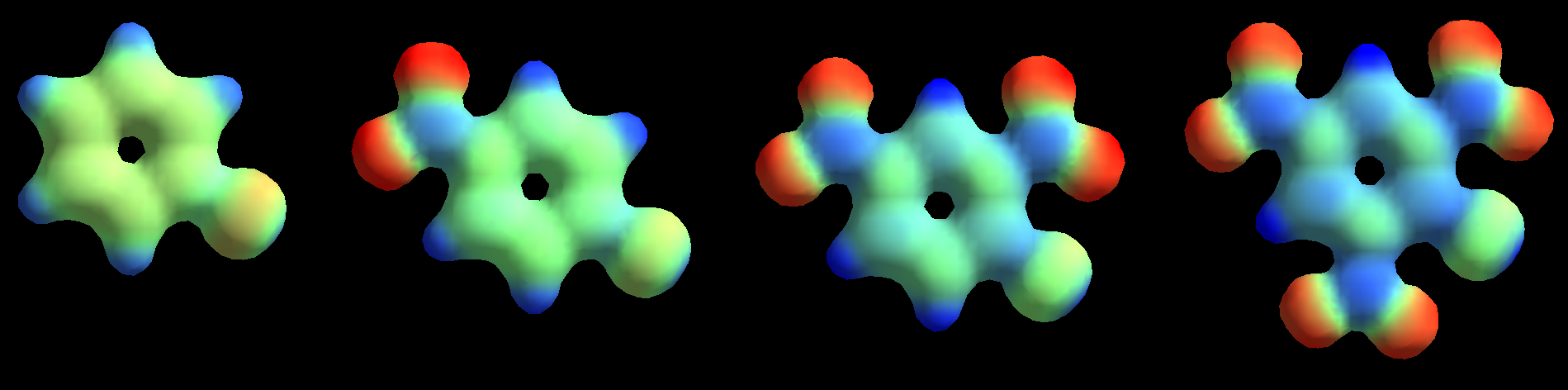SUSTITUCIÓN NUCLEÓFILA AROMÁTICA SNAr
Los haluros de arilo pueden dar reacciones de sustitución nucleófila (SNAr) pero de una manera muy diferente a como lo hacen los haluros de alquilo.
La reacción "normal" de un compuesto aromático es la sustitución electrófila (SEAr) porque el anillo es muy rico en electrones. Pero si el compuesto aromático tiene uno o varios sustituyentes fuertemente atractores de electrones, la sustitución nucleófila (SNAr) puede llegar a darse.
Clorobenceno
1-Cloro-4-nitrobenceno
1-Cloro-2,4-dinitrobenceno
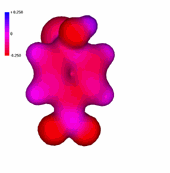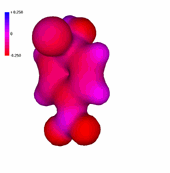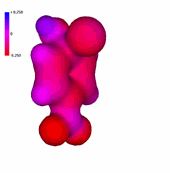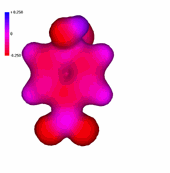
1-Cloro-2,4.6-trinitrobenceno
La presencia de un número creciente de grupos nitro, fuertemente atractores de electrones, hace que el anillo aromático tenga una deficiencia electrónica cada vez más importante, "más azul".
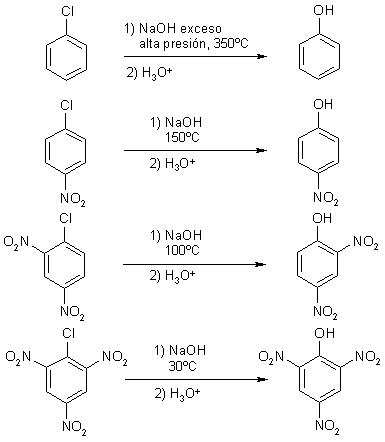
En esta situación un buen grupo saliente (por ejemplo cloro) puede ser desplazado por un nucleófilo fuerte (por ejemplo hidróxido):
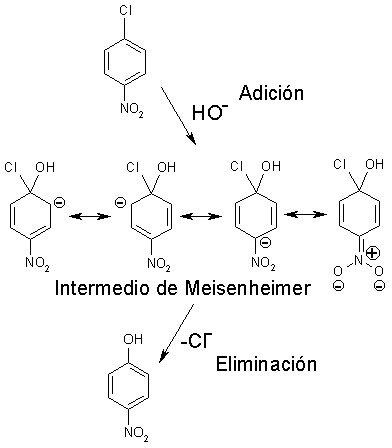
El clorobenceno reacciona con hidróxido (nucleófilo) en condiciones extraordinariamente drásticas. Sin embargo, la sustitución nucleófila del cloro se facilita enormemente si existen grupos atractores de electrones en el anillo. La reacción del 2,4,6-trinitroclorobenceno con hidróxido conduce al ácido pícrico (2,4,6-trinitrofenol) en condiciones muy suaves.
El ataque del nucleófilo (HO-) se produce en una trayectoria perpendicular al plano del anillo que es donde residen los orbitales p de la nube "pi".
El mecanismo de esta sustitución no tiene nada que ver con el de la alifática, sobre carbonos sp3.
Encontrarás un gran parecido al de la sustitución electrófila aromática: la aproximación del reactivo al anillo es muy parecida. Sin embargo, el desarrollo de carga es negativo, como corresponde a un ataque nucleófilo por parte de una especie con exceso de electrones.
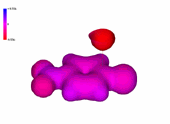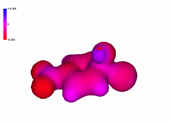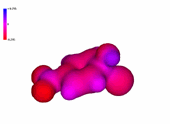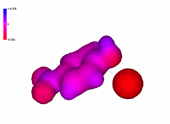
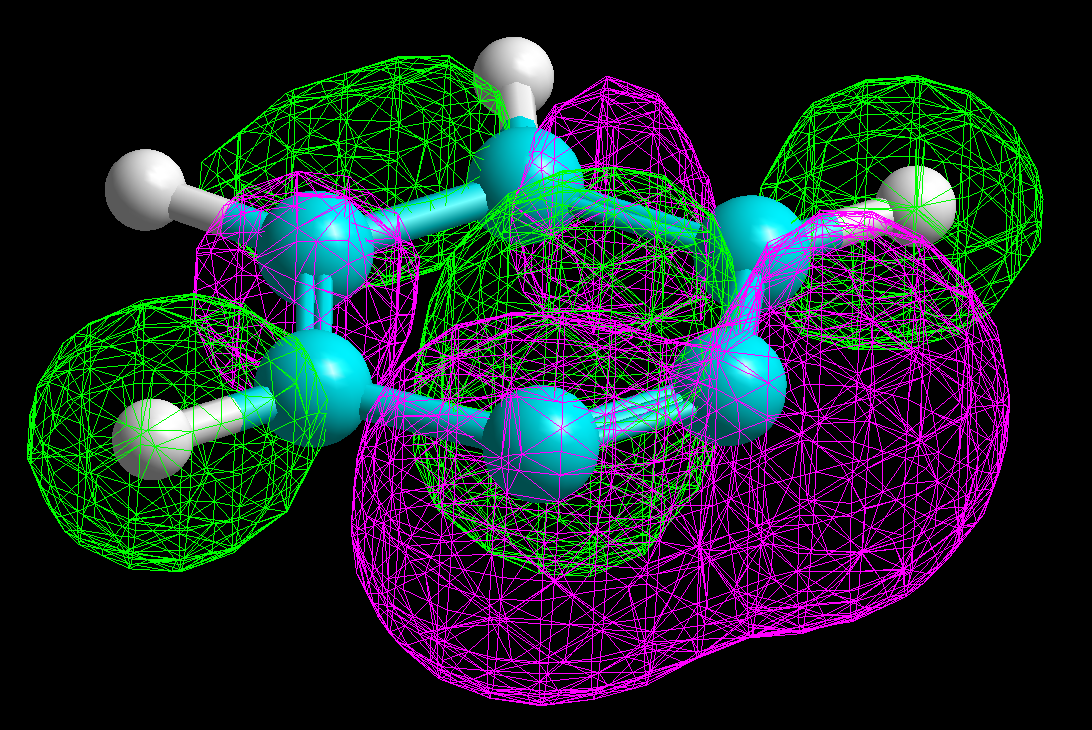
La deficiencia electrónica del carbono unido al cloro, aumentada por efecto del grupo NO2 en para, facilita la adición del hidróxido con carga negativa. Se forma así un intermedio (atribuido al químico Meisenheimer) cargado negativamente.
Puede verse en el modelo cómo la carga negativa se concentra especialmente en las posiciones orto y para respecto del carbono atacado. Las formas resonantes nos explican por qué. El grupo nitro en posición 4 ayuda a estabilizar la carga negativa.
Si comprendes este mecanismo podrás responder a esta pregunta:
¿Por qué el 3-nitroclorobenceno reacciona menos fácilmente con hidróxido que el 4-nitroclorobenceno?
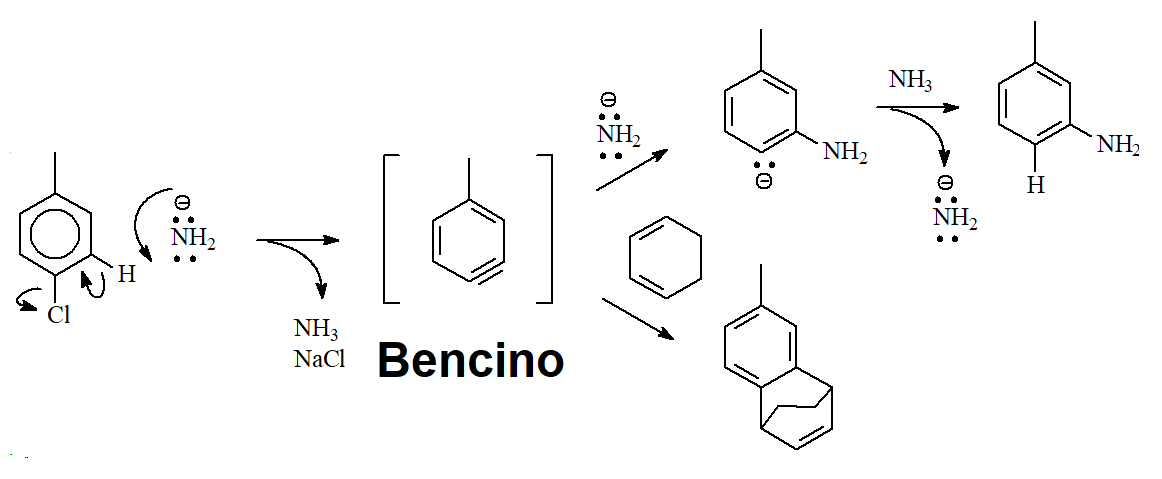
Mecanismo a través de Bencino
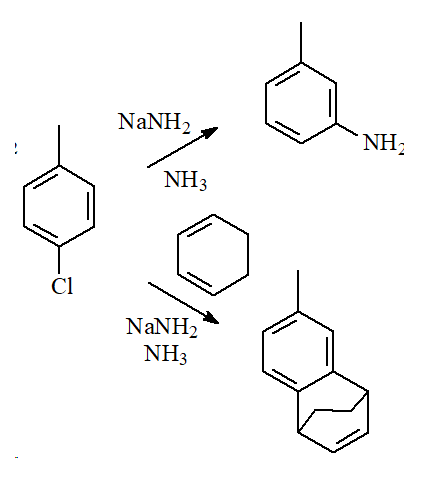
Hay otro mecanismo que nos permite explicar los hechos siguientes:
Por ejemplo:
1) El tolueno reacciona con una base fuerte como el amiduro sódico para dar m-toluidina(m-metilanilina).
2) Cuando la reacción se lleva a cabo en presencia de un buen dieno, como el 1,3-ciclohexadieno, se obtiene un aducto de Diels-Alder.
La reacción debe transcurrir a través de un intermedio de tipo "bencino" porque, si no, la producción del aducto Diels-Alder no sería entendible.
La estructura del bencino no puede explicarse como la de un triple enlace convencional, en el que hay dos nubes "pi" producidas por el solapamiento de los orbitales "p" correspondientes.
En el caso del bencino, una de las dos nubes "pi" está ocasionada por el solapamiento incompleto de dos orbitales sp2 que comparten dos electrones. El solapamiento es incompleto porque los dos orbitales sp2 no pueden ser paralelos por razones obvias de geometría.
Los triples enlaces convencionales son reactivos pero muy estables. El bencino es un intermedio reactivo muy inestable y extremadamente reactivo. Por ello se presencia tiene que ser revelada indirectamente mediante su "captura" por el dieno.