1) Densidad electrónica:
El grupo OH aumenta la densidad
electrónica del anillo. Los pares no compartidos del oxígeno
se deslocalizan hacia el anillo y su densidad electrónica aumenta,
sobre todo en las posiciones orto y para.
|
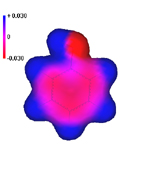
La zona con mayor densidad
electrónica es el oxígeno, como le corresponde por ser el
átomo más electronegativo. Pero puede observarse que dentro
del anillo, la densidad electrónica no está repartida uniformemente
como en el benceno, sino que las zonas rojas correspondientes a los carbonos
orto y para del oxígeno son ligeramente más
intensas que las meta.
Las formas resonantes con separación
de cargas contribuirán poco al híbrido de resonancia del
fenol pero nos permiten explicar por qué la carga está distribuída
no uniformemente y reside especialmente en las posiciones orto-para
al OH. |
2) Velocidad de reacción
relativa al benceno:
El fenol reacciona 1000
veces más rápido que el benceno. El grupo OH activa
el anillo aromático frente a la reacción de SEAr
y rebaja la energía de activación. Por tanto, el ion bencenonio
intermedio es más estable cuando está el grupo OH.
3) Orientación
de la sustitución:
La sustitución ocurre
mayoritariamente en orto-para. No se obtiene prácticamente
nada de compuesto meta. Por consiguiente, los iones bencenonio correspondientes
a los compuestos orto y para deben ser mucho menos inestables
que el del meta. Las formas resonantes de cada uno de los iones
nos dan la respuesta:
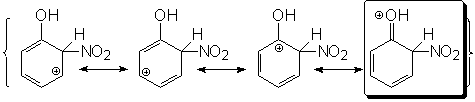
Sustitución en orto:
 |
|
La carga positiva se
deslocaliza por las posiciones orto y para respecto del carbono
atacado. En la 3ª forma resonante la carga positiva recae sobre el
carbono que soporta el grupo OH. El oxígeno deslocaliza la carga
positiva mediante la compartición de uno de sus pares de electrones
solitarios. El híbrido de resonancia del ion bencenonio orto
se describe mediante cuatro formas resonantes.
|
|
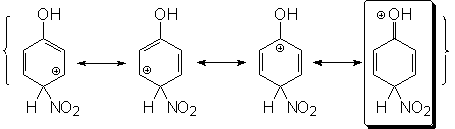
Sustitución en para:
|
|
La carga positiva se
deslocaliza por las posiciones orto y para respecto del carbono
atacado. En la 3ª forma resonante la carga positiva recae sobre el
carbono que soporta el grupo OH. El oxígeno deslocaliza la carga
positiva mediante la compartición de uno de sus pares de electrones
solitarios. El híbrido de resonancia del ion bencenonio para
también se describe mediante cuatro formas resonantes.
|
|
Sustitución en meta:

|
|
La carga positiva se
deslocaliza por las posiciones orto y para respecto del carbono
atacado. En ninguna de las formas resonantes la carga recae sobre el carbono
que soporta el grupo OH y, por tanto, éste no puede deslocalizarla
aún más. El híbrido de resonancia del ion bencenonio
meta
se describe tan sólo mediante tres formas resonantes.
|
|
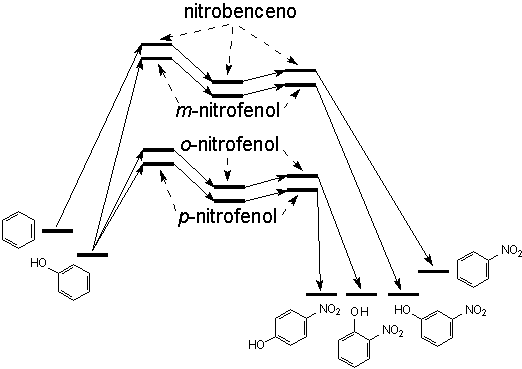
El diagrama de energía de la reacción
de nitración del fenol, en comparación del benceno, es cualitativamente
así:
El fenol reacciona más
rápido comparado con el benceno. Por tanto el camino de reacción
del benceno es el más alto en energía. De los tres posibles
caminos, orto, meta y para, el meta será
el siguiente más alto ya que el ion bencenonio meta es el
menos estabilizado por resonancia (ver arriba). El isómero que se
obtiene en mayor proporción es el para, y por ello el camino
que conduce a este isómero es el más bajo en energía.
Se obtiene una proporción
58:40 de para:orto pero posiciones orto hay dos y
para
una. Por tanto, al comparar las valocidades relativas de reacción
para:orto,
el
valor orto lo deberemos dividir por dos. Así que la posición
para del fenol reacciona 58:20 veces, es decir 2.9:1, más
rápido que la orto. |
|