RUPTURA DE ÉTERES EN MEDIOS ÁCIDOS FUERTES
Los éteres resisten el ataque de los nucleófilos porque el grupo saliente, que sería un alcóxido, es muy malo porque es una base muy fuerte.
El oxígeno de la unión éter tiene dos pares de electrones sin compartir y, por tanto, es básico. Con un ácido suficientemente fuerte pueden formar iones oxonio.
La calefacción del medio de reacción da lugar a la ruptura de uno de los enlaces C-O. Pero, ¿por dónde se rompera el éter protonado anterior?.
Así que un terc-butil éter puede utilizarse para bloquear o proteger un grupo alcohol, ya que el tratamiento ácido permite recuperarlo.
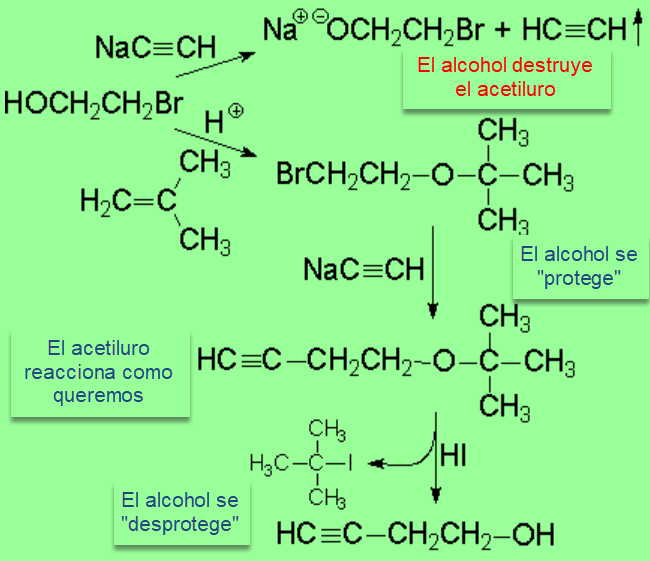 Este es un buen ejemplo de una técnica utilizada muy a menudo en Química Orgánica:
Este es un buen ejemplo de una técnica utilizada muy a menudo en Química Orgánica:
Protección de grupos funcionales.
Si quisiéramos obtener el 3-butin-1-ol a partir del 2-bromoetanol, no podemos hacer reaccionar a éste directamente con acetiluro sódico: el alcohol, relativamente ácido, destruirá el nucleófilo/base. Es imprescindible proteger antes el alcohol, formando el éter terc-butílico, por ejemplo. La función éter es totalmente inerte frente al acetiluro y permite a éste sustituir el halógeno. El grupo alcohol se recupera fácilmente por tratamiento con HI.
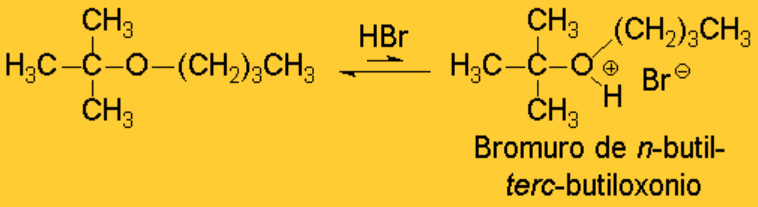
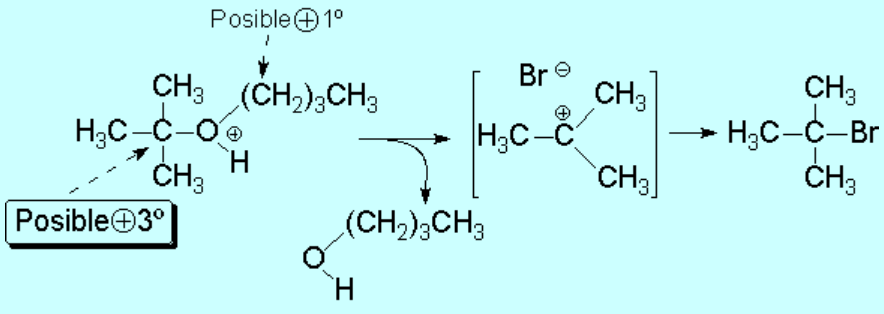
 Este es un buen ejemplo de una técnica utilizada muy a menudo en Química Orgánica:
Este es un buen ejemplo de una técnica utilizada muy a menudo en Química Orgánica: