Una reacción muy importante de las aminas es la que tiene lugar con el ácido nitroso. A tal proceso se le denomina nitrosación.
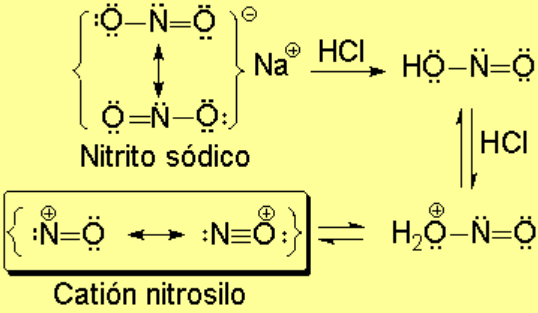
El ácido nitroso se descompone en medio ácido, dando lugar al catión nitrosilo, fuertemente electrófilo.
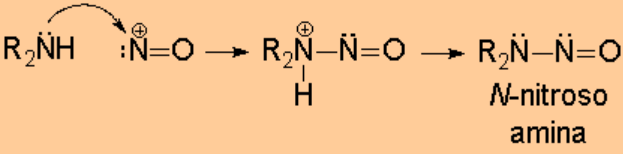
El catión nitrosilo es atacado por la amina para formar un ion N-nitroso que puede evolucionar de forma diferente dependiendo de si la amina es primaria, secundaria o terciaria.
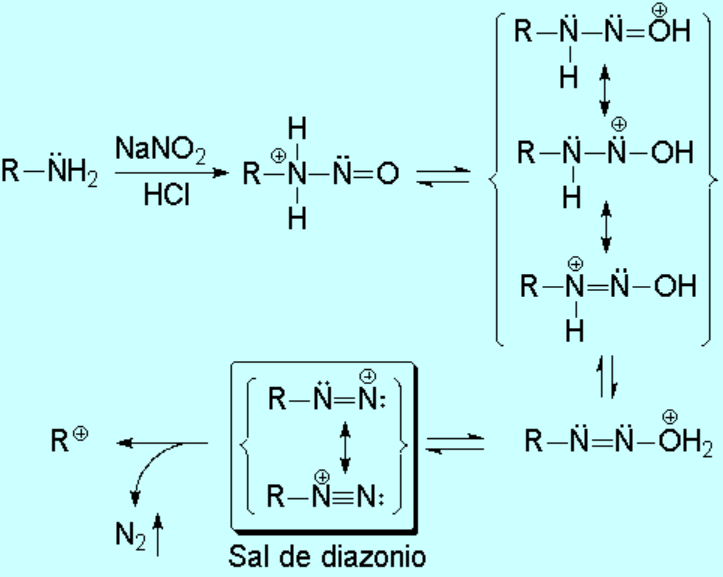
Los dos hidrógenos de la amina primaria permiten la eliminación de una molécula de agua. Así se obteniene una sal de diazonio muy reactiva, que pierde nitrógeno con facilidad, dando lugar a un carbocatión que reaccionará con cualquier nucleófilo que exista en el medio.
Las sales de diazonio alifáticas son muy inestables, incluso a baja temperatura, y se descomponen rápidamente. El carbocatión resultante reacciona de forma descontrolada con los nucleófilos presentes en el medio (por ejemplo agua, cloruro, etc.) produciendo una mezcla de alcoholes, haluros de alquilo y también alquenos por eliminación.
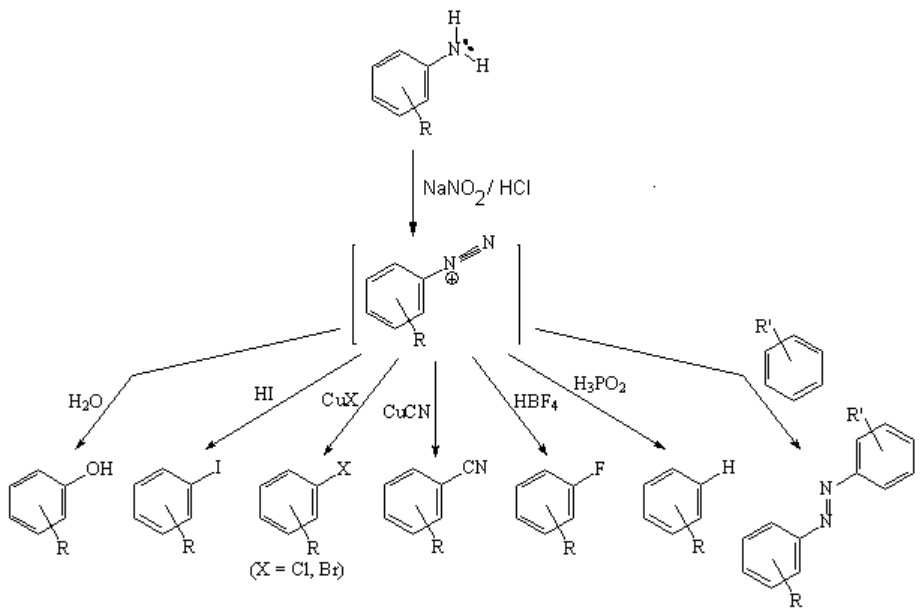
AMINAS PRIMARIAS AROMÁTICAS (ANILINAS)
La reacción más importante de las anilinas no sustituídas en el nitrógeno es su transformación en sales de diazonio, intermedios en la preparación de numerosos derivados aromáticos.
Las N-nitrosoaminas son muy peligrosas porque está demostrado que son agentes cancerígenos muy potentes.
Los nitritos (E-249 y E-250) son agentes conservantes de carnes y embutidos muy comunes, que evitan la proliferación de microorganismos que producen toxinas botulínicas, mortales para el ser humano.
Las N-nitrosoaminas pueden producirse por una sobrecocción de los alimentos que contengan nitritos.
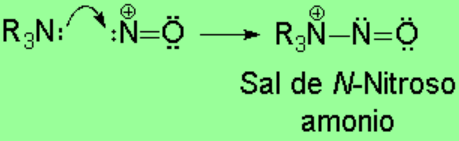
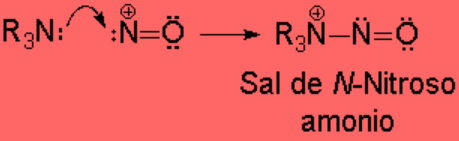
Las aminas terciarias no tienen ningún hidrógeno sobre el nitrógeno y la sal de N-nitrosoamonio no puede evolucionar. Sin embargo, se descomponen con facilidad.
La reacción no tiene utilidad sintética.