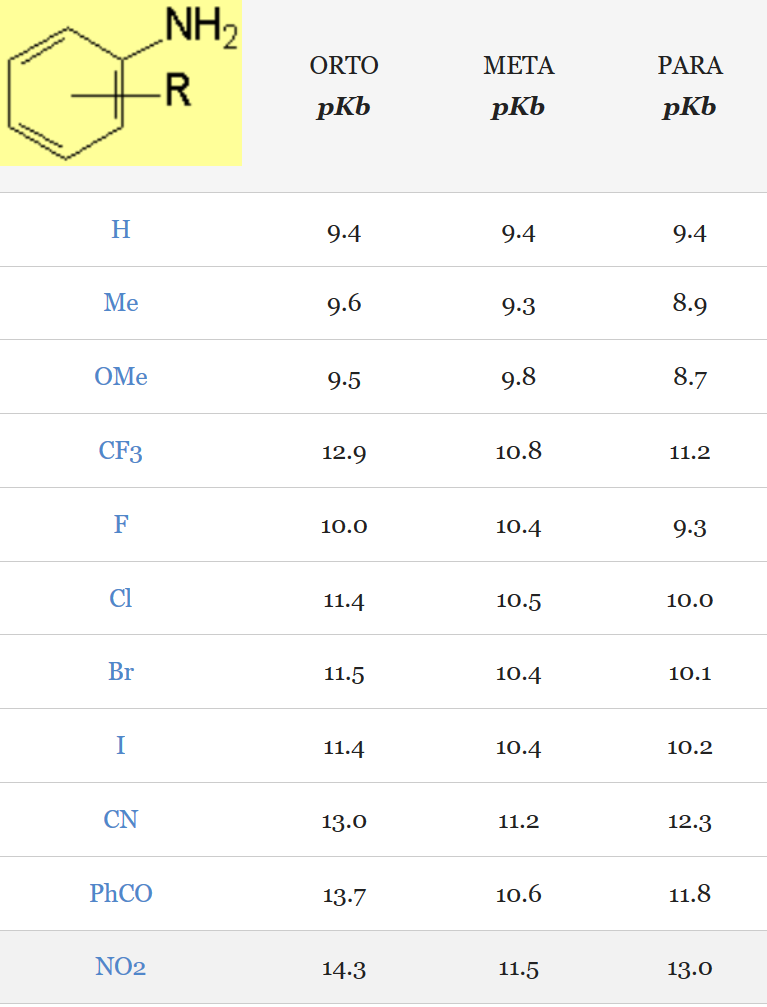

El grupo NO2 es el que más disminuye la basicidad de la anilina, independientemente en qué posición se encuentre. La cuantía de la disminución está en el orden orto > para > meta.
El grupo NO2 es fuertemente electronegativo y favorece la deslocalización del par electrónico no compartido del nitrógeno, disminuyendo drásticamente la basicidad de la anilina.
Sin embargo, a diferencia de lo que ocurría con los halógenos, la disminución de basicidad que el grupo NO2 produce en posición para, más remota, es mayor que en meta. Esto sugiere que la distancia no es un factor primordial para que el grupo NO2 ejerza su efecto de disminución de la basicidad. Por tanto, el mecanismo más importante usado por el grupo NO2 para deslocalizar el par de electrones no compartido del nitrógeno es el mesómero o de resonancia, que se puede ejercer en las posiciones orto y para pero no en la meta.
El efecto mesómero del grupo NO2 es el más potente de todos los grupos estudiados ya que la disminución de basicidad en para con el grupo NO2 es la mayor de toda la tabla.
El efecto inductivo del grupo NO2 es también el más potente ya que la disminución de la basicidad en meta es la mayor de toda la tabla.
La suma de los efectos inductivo, mesómero y estérico del grupo NO2 es también la mayor ya que la disminución de la basicidad en orto es también la mayor de toda la tabla.
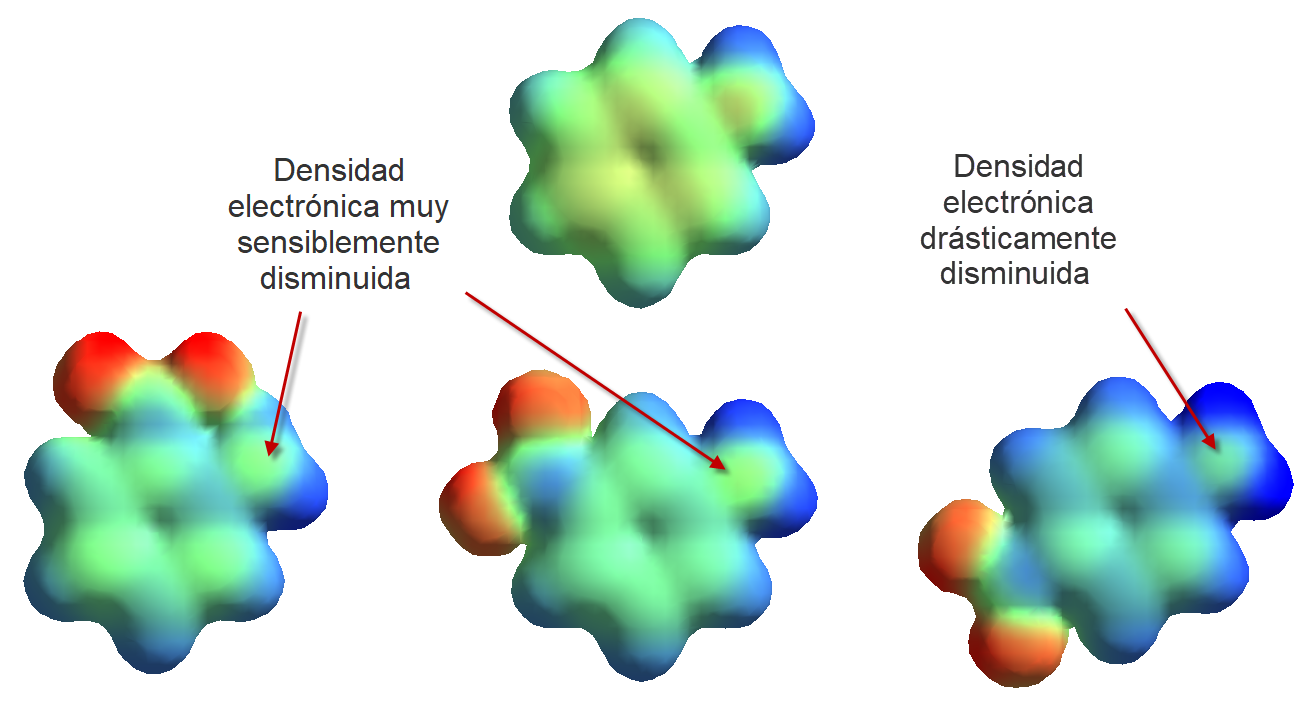
El cálculo de la densidad electrónica permite apreciar una sensible disminución entre la densidad electrónica del nitrógeno de la anilina (arriba) y las tres nitroaninilas, especialmente en posición para, lo que está de acuerdo con los drásticos aumentos en los valores de pKb experimentales ejercidos por el grupo NO2.