Los alcanos son los compuestos orgánicos menos reactivos ya que carecen de grupos funcionales y, por tanto, de enlaces polarizados.
Las energías de enlace no son muy diferentes en los alcanos respecto de otros compuestos que sabemos son mucho más reactivos:
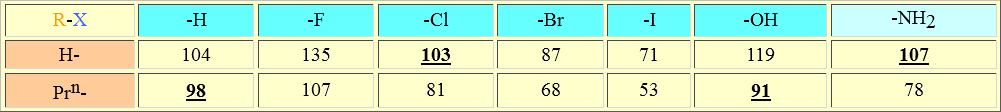
Se necesitan energías similares para romper un enlace C-H en el propano (98 kcal/mol), un enlace Cl-H en el cloruro de hidrógeno (103 kcal/mol), un enlace C-O en el propanol (91 kcal/mol) o un enlace N-H en el amoníaco (107 kcal/mol). Pero cualquiera de las tres últimas moléculas es mucho más reactiva que el propano. ¿Por qué?.
 Se producen dos especies con un electrón "impar", denominadas RADICALES LIBRES.
Se producen dos especies con un electrón "impar", denominadas RADICALES LIBRES.
Ruptura HOMOLÍTICA: Los dos electrones del enlace se reparten entre los dos átomos inicialmente enlazados. Esta ruptura es generalmente muy difícil y se da cuando el hidrógeno está unido a un átomo de electronegatividad baja o moderada.
Los alcanos sólo dan reacciones mediante ruptura HOMOLÍTICA, que es la más costosa energéticamente.
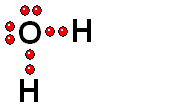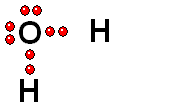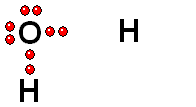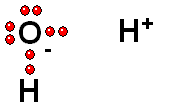 Se producen dos especies cargadas: un ANIÓN (negativo) y un CATIÓN (positivo).
Se producen dos especies cargadas: un ANIÓN (negativo) y un CATIÓN (positivo).
Ruptura HETEROLÍTICA: Los dos electrones del enlace se quedan del lado del átomo más electronegativo de los dos que forman el enlace. Esta es la forma más común de ruptura. Se da cuando el hidrógeno está unido a un átomo de electronegatividad alta.
REACCIONES TÍPICAS DE ALCANOS
 Se producen dos especies con un electrón "impar", denominadas RADICALES LIBRES.
Se producen dos especies con un electrón "impar", denominadas RADICALES LIBRES.
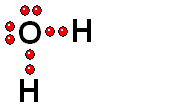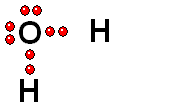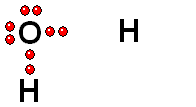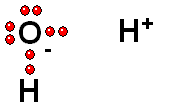 Se producen dos especies cargadas: un ANIÓN (negativo) y un CATIÓN (positivo).
Se producen dos especies cargadas: un ANIÓN (negativo) y un CATIÓN (positivo).