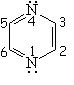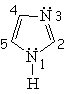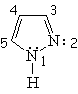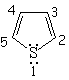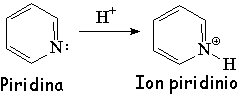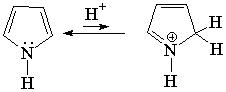COMPUESTOS HETEROAROMÁTICOS
Los compuestos heteroaromáticos pueden contener varios heteroátomos en varios de sus anillos. El límite está, como siempre, en tu imaginación.
Hückel enunció reglas para la aromaticidad y antiaromaticidad:
Un sistema de enlaces pi es aromático si es:
1) conjugado
2) cíclico
3) plano
4) poseedor de 4n + 2 electrones.
IMPORTANTE: Si contiene 4n electrones es antiaromático
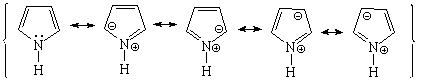
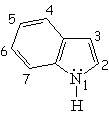
Todos las moléculas a continuación cumplen las condiciones anteriores. Para contar los 4n+2 electrones pi, los heteroátomos ponen en juego, o no, sus electrones no compartidos.
 |
 |
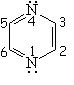 |
 |
|---|
| | | |
| Piridina | Pirimidina | Pirazina | Quinolina |
 |
 |
 |
 |
|---|
| | | |
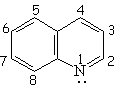
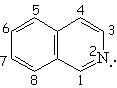
| Isoquinolina | Pirrol | Indol | Purina |
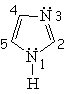 |
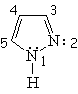 |
 |
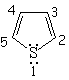 |
|---|
| | | |
| Imidazol | Pirazol | Furano | Tiofeno |
Los pares de electrones no compartidos de los heteroátomos pueden o no participar en los 4n+2 electrones, que son condición de aromaticidad, dependiendo de la estructura. En este sentido, ¿qué puedes deducir de los siguientes datos de basicidad?.
pKb = 8.8
La piridina es básica.
Esto indica que el par de electrones de la piridina NO ESTÁ IMPLICADO en la aromaticidad del anillo. Los electrones p por sí sólos cumplen la regla de Hückel de los 4n+2 (n=1) electrones.
pKb > 18
El pirrol no es básico.
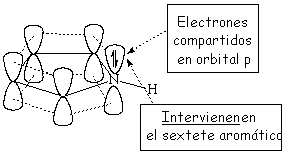
Esto indica que el par de electrones del pirrol SÍ ESTÁ IMPLICADO en la aromaticidad del anillo, está muy deslocalizado y no puede reaccionar con un ácido externo. La regla de Hückel de los 4n+2 (n=1) electrones se cumple contando los cuatro electrones de los cuatro carbonos y los dos del nitrógeno.
La estructura electrónica de ambos anillos nos permite comprender sus propiedades de basicidad diferentes:
En cuanto a la reactividad, ¿son la piridina y el pirrol más o menos reactivos que el benceno? ¿Cuál es tu apuesta?
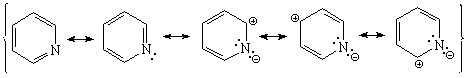
El nitrógeno de la piridina retira carga del anillo aromático.
La piridina es menos reactiva que el benceno frente a la SEAr.
El nitrógeno del pirrol no puede retirar carga del anillo. En todo caso puede cederla.
El pirrol es más reactivo que el benceno frente a la SEAr.