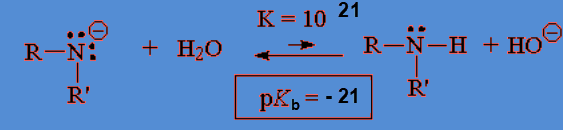
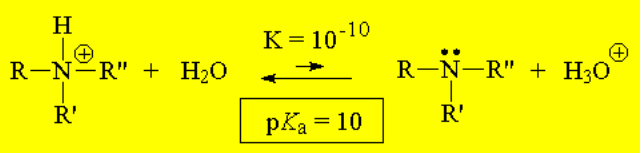
Las aminas son moderadamente básicas. Las sales de amonio, sus ácidos conjugados, son moderadamente ácidas.
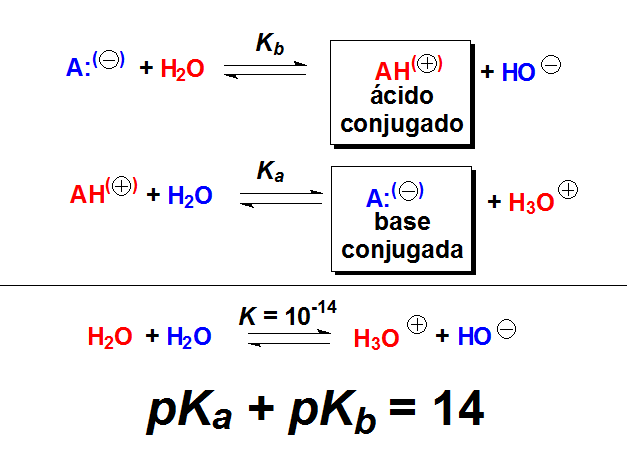
El pKa y el pKb están relacionados por la constante de equilibrio del producto iónico del agua. Por tanto, a partir del pKa de un ácido podemos conocer el pKb de su base conjugada y viceversa, restando de 14.
Las aminas con al menos un N-H son muy débilmente ácidas. Sus bases conjugadas, los amiduros, son bases extraordinariamente fuertes
La acidez de una alcano es mínima (pKa
> 50). La acidez de una amina (pKa=35) es, por lo menos, 15 órdenes de magnitud mayor. Es decir, el anión N(-) proveniente de una amina es más estable que el C(-) proveniente de un alcano.
Esto es consecuencia de la mayor electronegatividad del nitrógeno respecto del carbono, que hace que un ion amiduro sea relativamente más estable que un carbanión homólogo.
Las aminas aromáticas (anilinas) son menos básicas que las aminas y, por consiguiente, las sales de anilinio son más ácidas que las de amonio.

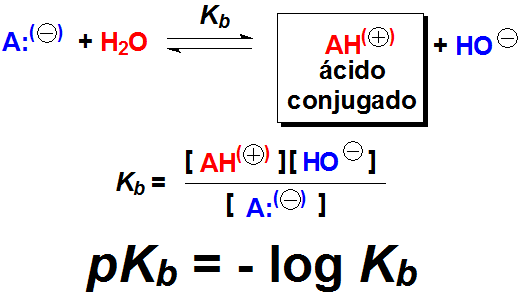 Cuanto mayor la basicidad, más desplazado está el equilibrio hacia la formación de HO(-), mayor la Kb y menor el valor de pKb.
Cuanto mayor la basicidad, más desplazado está el equilibrio hacia la formación de HO(-), mayor la Kb y menor el valor de pKb.
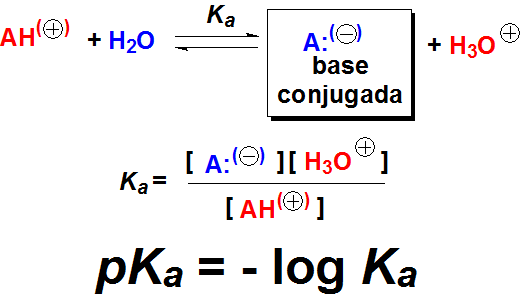 Cuanto mayor la acidez, más desplazado está el equilibrio hacia la formación de H(+), mayor la Ka y menor el valor de pKa.
Cuanto mayor la acidez, más desplazado está el equilibrio hacia la formación de H(+), mayor la Ka y menor el valor de pKa.