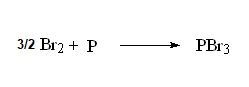HALOGENACIÓN EN ALFA DE ÁCIDOS CARBOXÍLICOS
La halogenación en alfa de un ácido carboxílico puede lograrse con bromo molecular y fósforo atómico rojo.
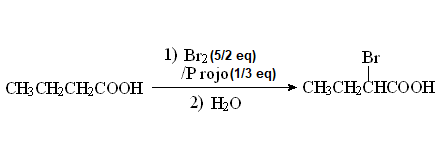 La reacción toma el nombre de sus descubridores: Hell-Volhard-Zelinski
La reacción toma el nombre de sus descubridores: Hell-Volhard-Zelinski
Se consigue así funcionalizar la posición alfa de un ácido y activarla para poder efectuar reacciones posteriores.
Carl Magnus von Hell (8 Septiembre 1849 – 11 Deciembre 1926) fue un químico alemán que descubrió, junto a Jacob Volhard y Nikolay Zelinsky, la halogenación en alfa de ácidos carboxílicos.
Jacob Volhard (4 Junio 1834 – 14 Enero 1910) fue el químico alemán responsable de la mejora de la halogenación en alfa de ácidos carboxílicos.
Nikolay Dimitrievich Zelinsky (6 Febrero 1861 en Tiraspol, Imperio Ruso – 31 July 1953 en Moscú), químico ruso y soviético, académico de la Academia de Ciencias de la USSR (1929). Fue uno de los fundadores de la catálisis orgánica e inventor de la primera máscara de gas efectiva (1915).
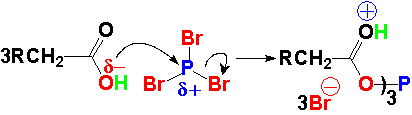
El fósforo del PBr3 es muy electrófilo al estar unido a tres halógenos y es atacado por el oxígeno del ácido carboxílico, que es débilmente básico.
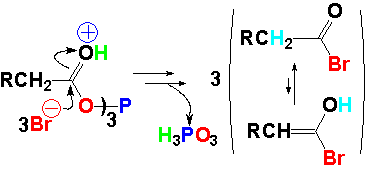
Se forma un anhídrido triple. El oxígeno unido al fósforo resulta un buen grupo saliente. El HBr protona al carbonilo que queda así bien preparado para el ataque nucleófilo del bromuro.
El ataque del bromuro produce un bromuro de ácido. La reacción es análoga a la estudiada con el cloruro de tionilo. El bromuro de ácido con hidrógenos en alfa está en equilibrio con unas pocas moléculas de enol.
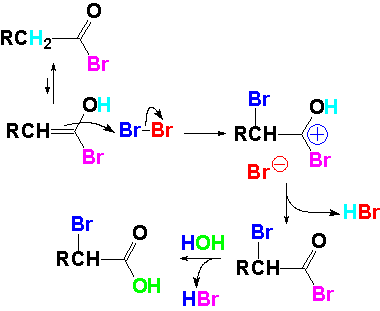
El ataque del bromuro produce un intermedio en el que el carbono atacado pasa a ser sp3. A partir de este intermedio se produce la pérdida de ácido hipofosforoso y se recupera la hibridación sp2. Las pocas moléculas de enol en equilibrio pueden reaccionar con el Br2 en exceso.
El enol rompe una molécula de bromo. Se adiciona un átomo al doble enlace, que acaba en la posición alfa. Se forma un bromuro de ácido bromado en posición alfa. La hidrólisis del bromuro de ácido produce el ácido carboxílico que conserva el halógeno en posición alfa.
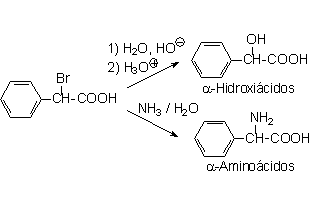
La halogenación en alfa es una reacción muy útil para activar la posición contigua a un ácido carboxílico y poder obtener otros productos interesantes como alfa-hidroxi y alfa-amino ácidos
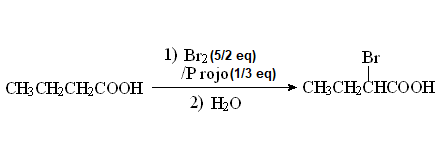 La reacción toma el nombre de sus descubridores: Hell-Volhard-Zelinski
La reacción toma el nombre de sus descubridores: Hell-Volhard-Zelinski