SUSTITUCIÓN NUCLEÓFILA UNIMOLECULAR (Sn1)
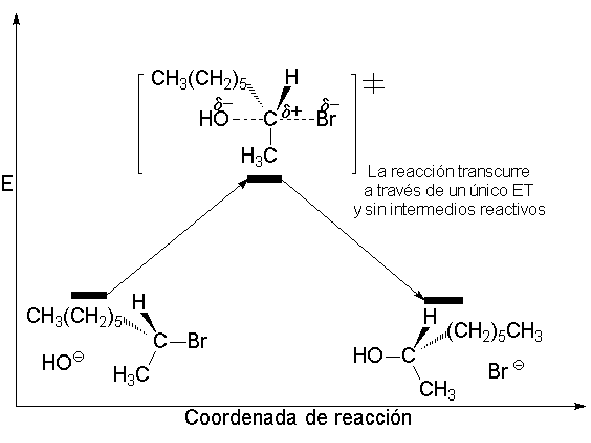
Hemos explicado detalladamente cómo es el mecanismo (SN2) que da lugar a inversión y conduce al producto mayoritario de nuestro experimento (S)-2-octanol.
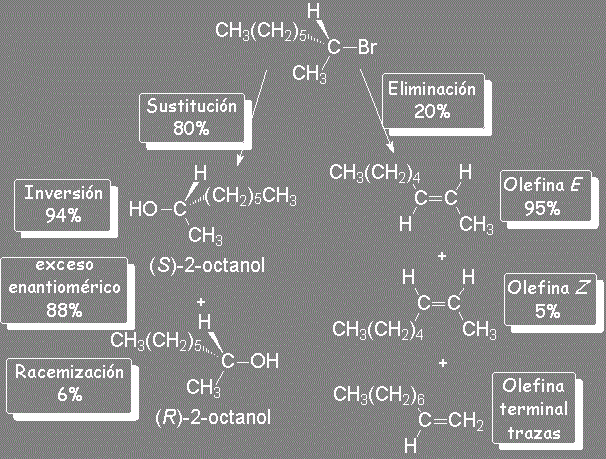
Pero, ¿cómo se obtiene la pequeña cantidad de (R)-2-octanol?
Tenemos que recurrir a un mecanismo alternativo: La sustitución nucleófila unimolecular (SN1).
El enlace C-Br del 2-bromooctano esta muy polarizado hacia el bromo, más electronegativo. La presencia del disolvente polar puede provocar la ruptura de este enlace. Los iones resultantes quedarán más o menos separados por el disolvente.
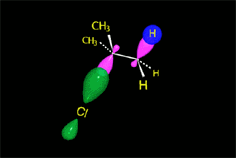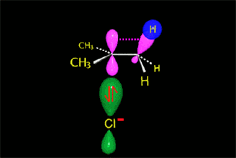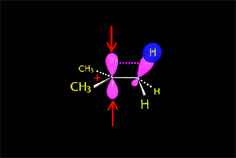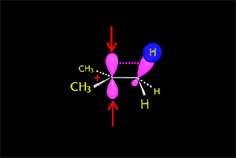
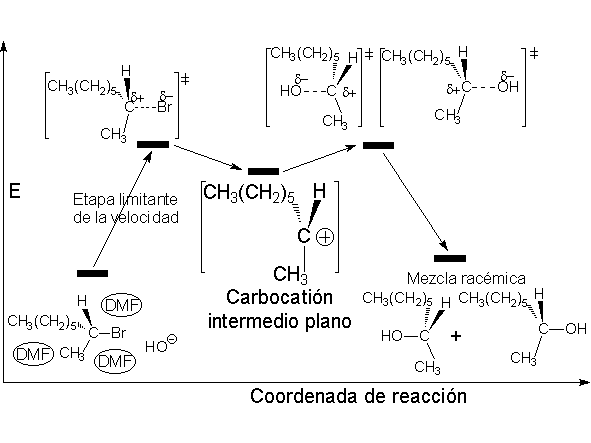
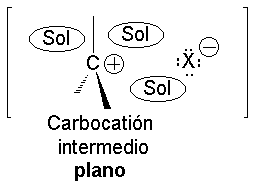
El carbocatión formado es plano. El carbono está hidridado sp2. El orbital p vacío, perpendicular al plano del carbocatión, puede ser atacado con igual probabilidad por sus dos lóbulos.
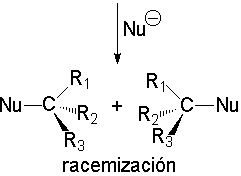
El ataque del nucleófilo por un lado u otro da lugar a los dos enantiómeros posibles. Como el ataque a un lado u otro tiene igual probabibilidad de darse, los enantiómeros se producen en igual proporción, obteniéndose una mezcla racémica.
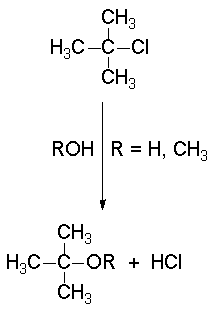
Las reacciones SN1, como la solvolisis de cloruro de terc-butilo, tienen una cinética de primer orden.
Velocidad = k[(CH3)3CCl] mol/L·s
Esto quiere decir que en la etapa limitante de la velocidad sólo interviene el haluro y no el nucleófilo, al contrario de lo que ocurría en el mecanismo SN2. Mira las diferencias en movimiento:
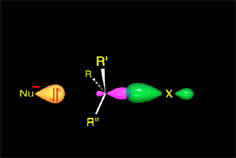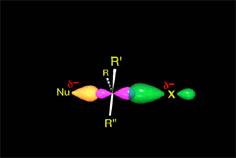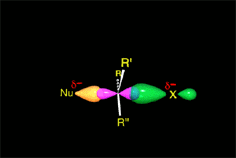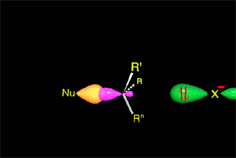 SN2
SN2
 SN1 (carbocatión)
SN1 (carbocatión)
El carbocatión es atacado por el nucleófilo.
En la solvolisis del cloruro de terc-butilo el nucleófilo es el propio disolvente que colapsa con el carbocatión. Otra molécula de disolvente abstrae el protón que sobra.
Los perfiles de energía de ambos procesos SN1 y SN2 son:
 SN2
SN2
 SN1 (carbocatión)
SN1 (carbocatión)
La reacción SN1 carece de estereoespecificidad al transcurrir a través de un intermedio carbocatiónico plano.
En la sustitución los mecanismos SN1 y SN2 compiten entre sí.
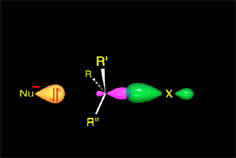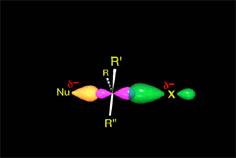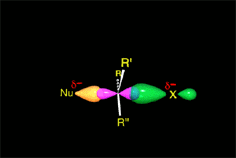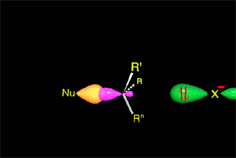 SN2
SN2
 SN1 (carbocatión)
SN1 (carbocatión)
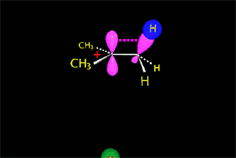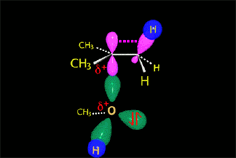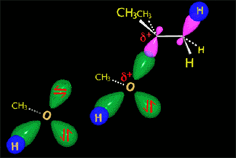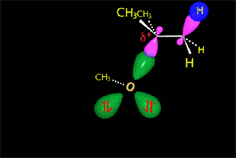
 SN2
SN2
 SN1 (carbocatión)
SN1 (carbocatión)