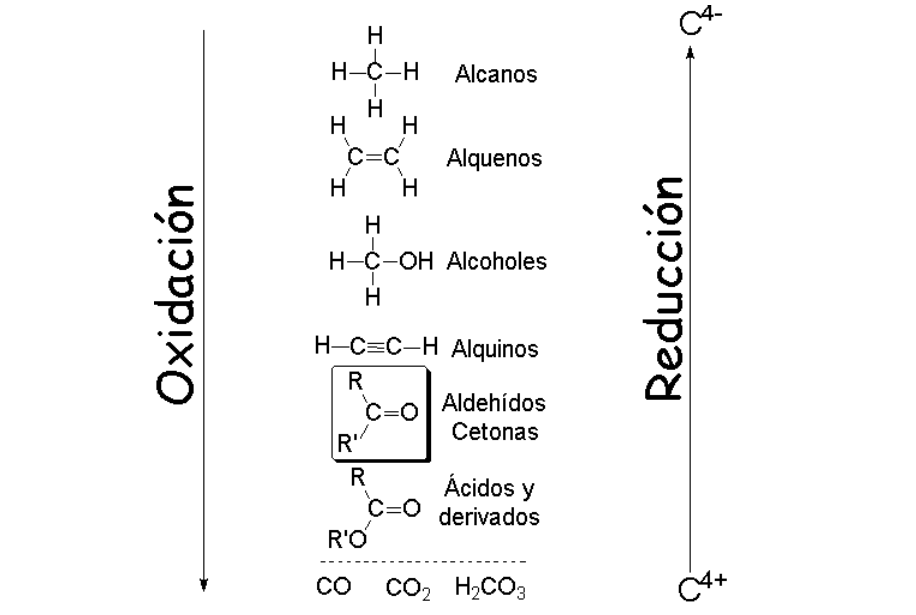
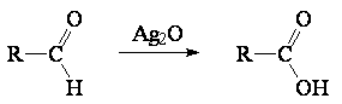OXIDACIÓN DE ALDEHÍDOS Y CETONAS
En los aldehídos y cetonas el estado de oxidación formal del carbono carbonílico es +1 y +2, respectivamente. En los ácidos carboxílicos y sus derivados es +3, lo que significa que un aldehído o cetona todavía puede oxidarse, con el reactivo apropiado, para dar un ácido carboxílico o derivado.
La oxidación de aldehídos es muy fácil y puede lograrse con reactivos de oxidación muy suaves como el óxido de plata (Ag2O).
El óxido de plata es un oxidante muy suave que resulta selectivo de aldehídos. Cualquier otra función en la molécula NO se oxidará.
Por supuesto, oxidantes más fuertes que sí oxidan otras funciones (KMnO4, K2Cr2O7) también oxidarán los aldehídos a ácidos carboxílicos.
IMPORTANTE: Si en una molécula compleja tienes una función aldehído y no quieres que se oxide, tendrás que protegerla antes.
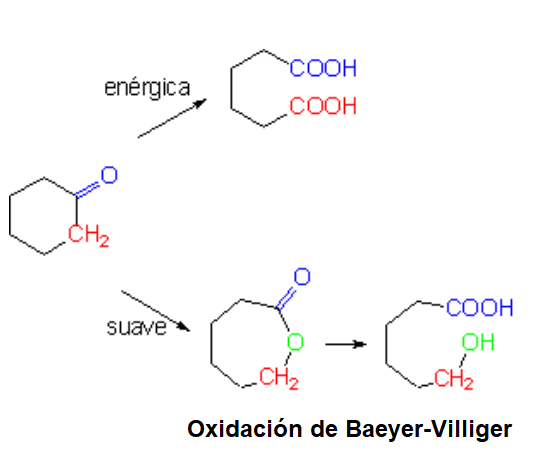
La oxidación de cetonas pasa obligatoriamente por la ruptura de un enlace C-C.
Si es enérgica (KMnO4, K2Cr2O7) se producen dos ácidos carboxílicos.
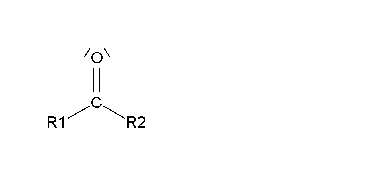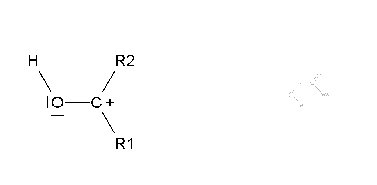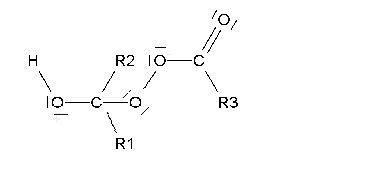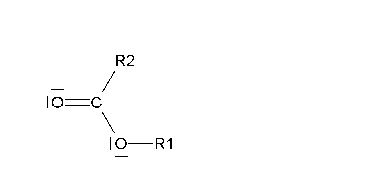
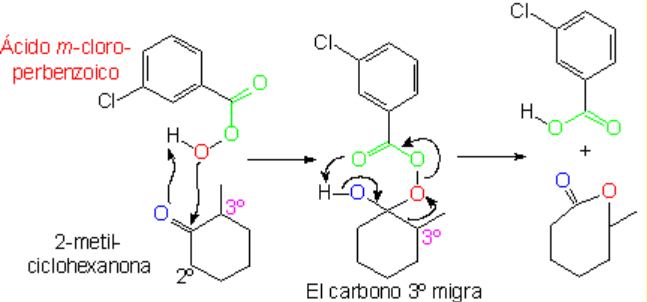
Si suave (oxidación de Baeyer-Villiger), se produce un éster que, una vez hidrolizado, da lugar a un ácido y un alcohol.
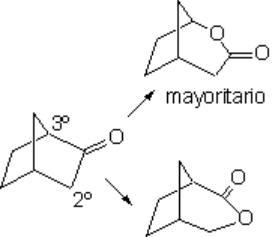
Si la cetona no es cíclica, la oxidación da lugar a una mezcla de dos moléculas, lo que desde el punto de vista preparativo puede ser un inconveniente. La oxidación de cetonas incluídas en un anillo está exenta de ese inconveniente.
Oxidación de Baeyer-Villiger
La oxidación suave de cetonas no simétricas plantea el problema de en qué lado se inserta el oxígeno.
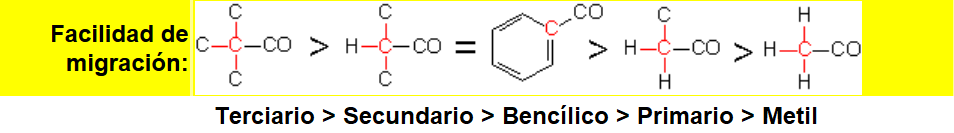
La reacción suele ser muy regioselectiva, insertándose el oxígeno del lado del carbono más sustituído.
La inserción del oxígeno (en rojo) implica la migración de uno de los restos alquilo. Migra preferentemente el más sustituído.