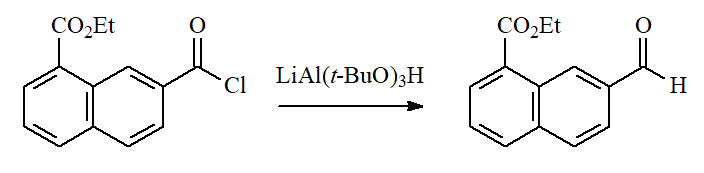REACTIVIDAD DE HALUROS DE ACILO
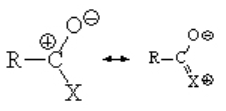
Los haluros de ácido son los más reactivos de los derivados de ácidos carboxílicos porque la contribución de la forma resonante con carga sobre el grupo L (halógeno) es despreciable.
El mecanismo es el habitual de adición-eliminación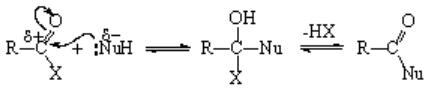
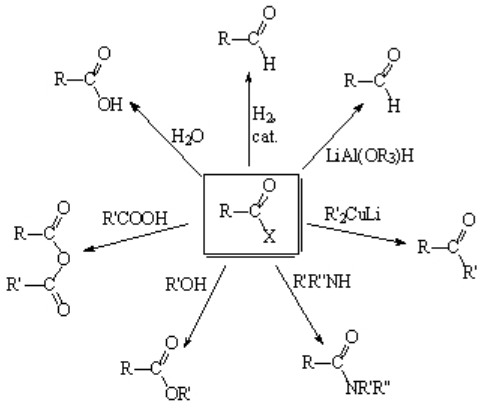
La versatilidad de la función cloruro de acilo es enorme y permite su transformación en otros grupos funcionales muy importantes.
Muchos de ellos los conocerás por primera vez...
Los haluros de acilo se convierten en ÁCIDOS CARBOXÍLICOS con el mero contacto con humedad. Por tanto, hay que almacenarlos en atmósfera seca e inerte (nitrógeno o argon seco)
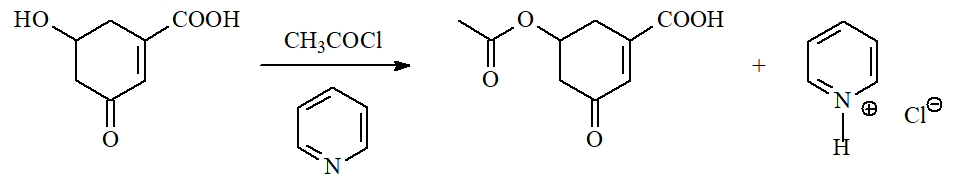
Con alcoholes producen ÉSTERES. La reacción requiere de manera imprescindible una base para capturar el HCl que se desprende.
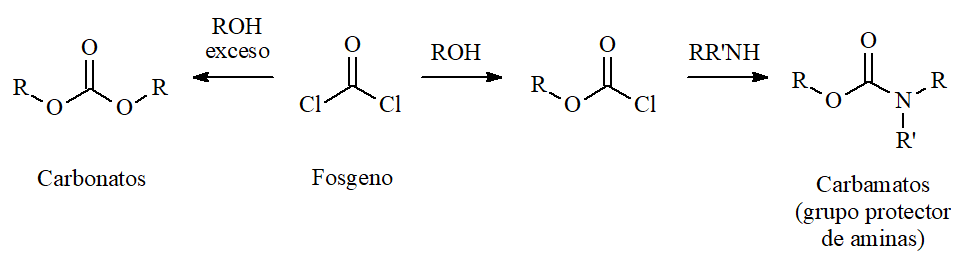
El fosgeno es como un haluro de acilo "doble" del ácido fórmico, que puede reaccionar con un exceso de alcohol para dar CARBONATOS o, si reacciona con un equivalente de alcohol, todavía tiene otro cloruro que puede reaccionar con aminas y dar lugar a CARBAMATOS.
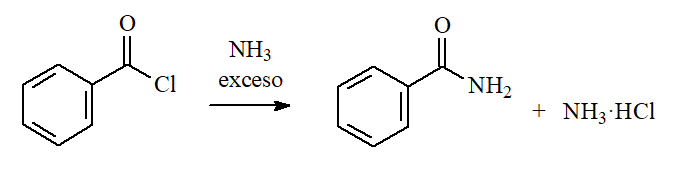
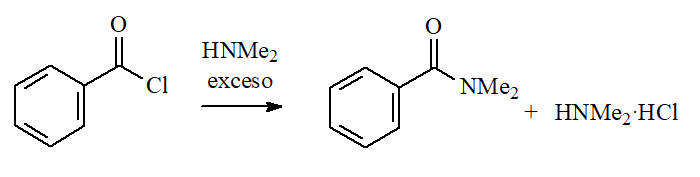
El amoníaco y las aminas primarias o secundarias (¡NO terciarias!) conducen a AMIDAS. La propia amina en exceso se encarga de capturar el HCl desprendido.
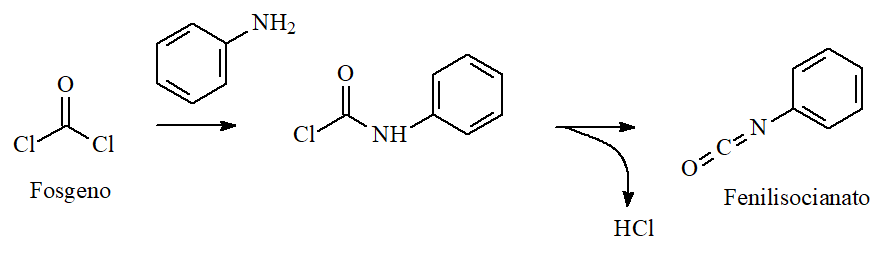
Los ISOCIANATOS (R-N=C=O) contienen un grupo funcional relacionado con los derivados de ácidos carboxílicos, que pueden prepararse a partir de fosgeno y aminas primarias, pasando por un compuesto intermedio que posee el grupo Cl-C=O.
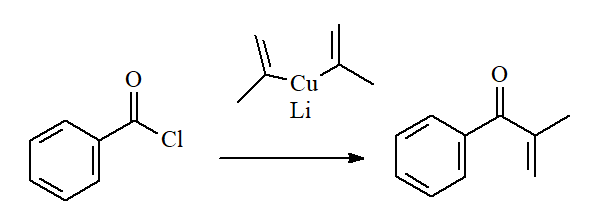
Los reactivos organometálicos covalentes y relativamente poco reactivos dan lugar a CETONAS. Un excelente ejemplo son los alquilcupratos de litio.
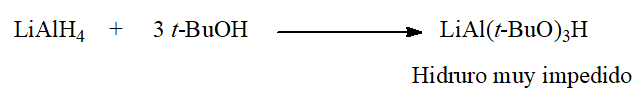
Los hidruros "desactivados" son capaces de efectuar el reemplazo formal del halógeno por un hidruro, dando lugar a ALDEHÍDOS.
Muchas funciones resisten estas condiciones suaves de reducción.
¿Te has preguntado por qué no se puede utilizar el LiAlH4 directamente?
Hidrogenación con el Catalizador de Lindlar
¿Recuerdas el catalizador de Lindlar? Una superficie de Pd parcialmente "envenenada" con quinolina y otros aditivos. La hidrogenación de cloruros de ácido con este catalizador también conduce a ALDEHÍDOS.
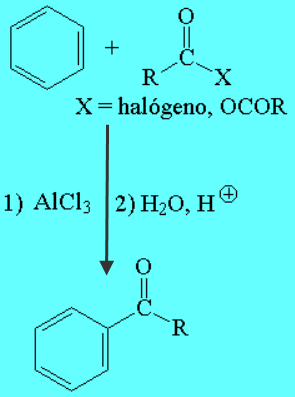
Compuestos Aromáticos (Acilación de Friedel-Crafts)
Otras Reacciones (Ardnt-Eistert y Dehidrohalogenación)
Reacción de Ardnt-Eistert:
El diazometano es capaz de reaccionar con los cloruros de acilo para dar DIAZOCETONAS, especies muy reactivas que por oxidación dan lugar a ÉSTERES.
El resultado de la reacción es la "inserción" formal de un grupo CH2 entre el grupo carbonilo y el resto R unido inicialmente a él. A esto se le denomina HOMOLOGACIÓN de derivados de ácidos carboxílicos.
El mecanismo es muy complejo pero resulta un buen ejercicio de Química Orgánica.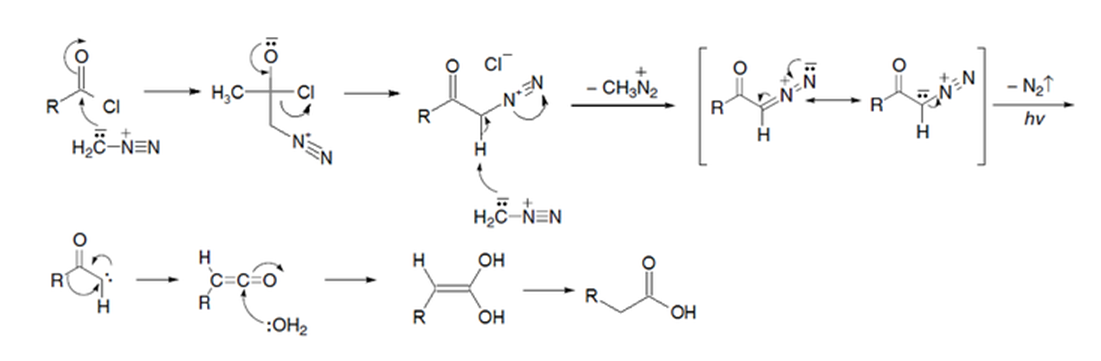
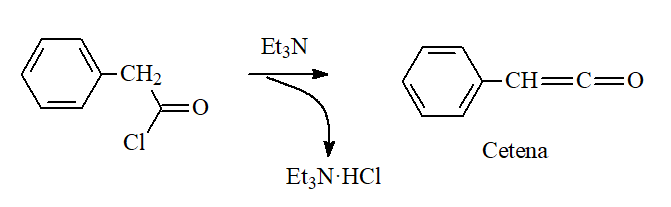
Las aminas terciarias NO pueden dar amidas con los cloruros de acilo pero su elevada basicidad permite "capturar" una molécula de HCl y convertirlos en CETENAS (R-C=C=O).
Para que esta reacción tenga lugar el cloruro de acilo tiene que tener al menos un hidrógeno en alfa.