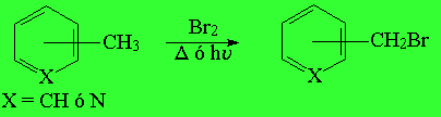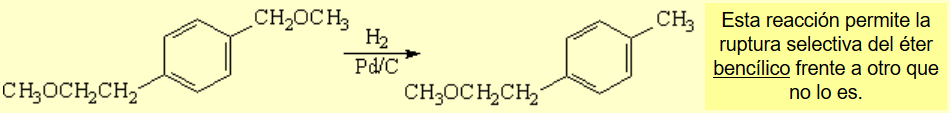LA POSICIÓN BENCÍLICA:
ALQUILARENOS
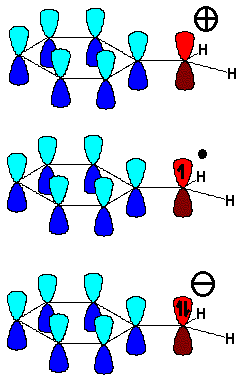
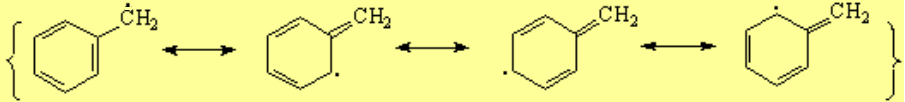
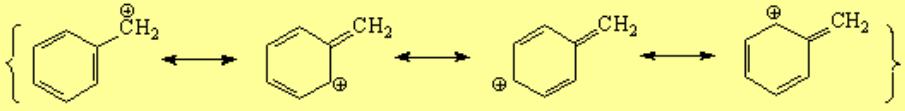
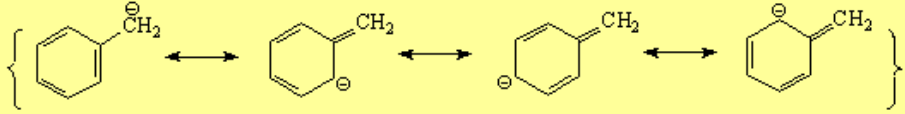
En la posición bencílica es relativamente fácil crear excesos o defectos de electrones porque la nube "pi " del anillo aromático se encargará de deslocalizarlos.
El carbono unido al anillo aromático, ya sea un centro carbocatiónico, radical o carbanión, adopta una hibridación sp2 y el orbital "p sobrante" se conjuga con los orbitales "pi" del anillo.
Las reacciones que transcurren por medio de un carbocatión, radical o carbanión bencílico son más fáciles de lo esperado.
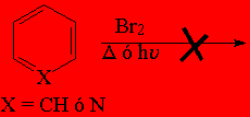
Los compuestos aromáticos como el benceno o la piridina NO REACCIONAN con bromo sin catalizador, como lo haría un alqueno (adición) o un alcano (halogenación radicálica).
El tolueno y la metilpiridina SÍ REACCIONAN, pero a través del grupo metilo (halogenación radicálica) y con especial facilidad.
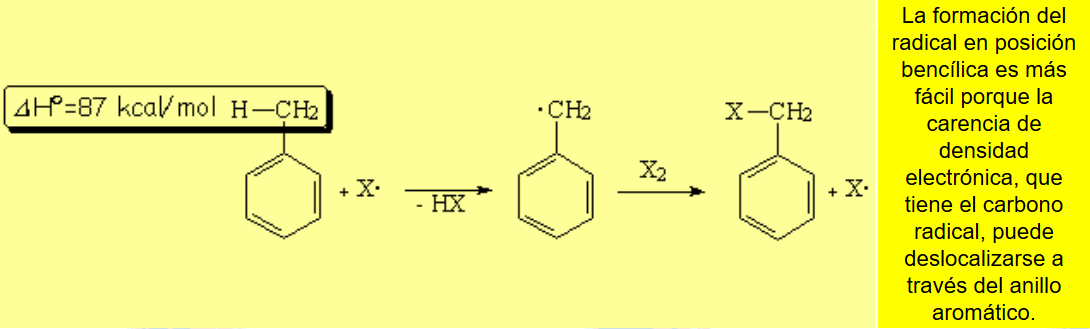
La halogenación en la posición bencílica es especialmente favorable. Cuesta menos energía que sobre un carbono alquílico "normal". Los enlaces C-H de la posición bencílica son más débiles de lo esperado.
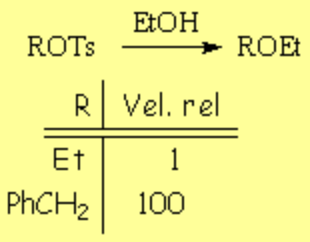
La solvolisis de un tosilato es más rápida en posición bencílica, porque probablemente transcurre a través de un carbocatión bencílico mucho menos inestable de lo normal.
Pincha aquí para recordar la SN alifática.
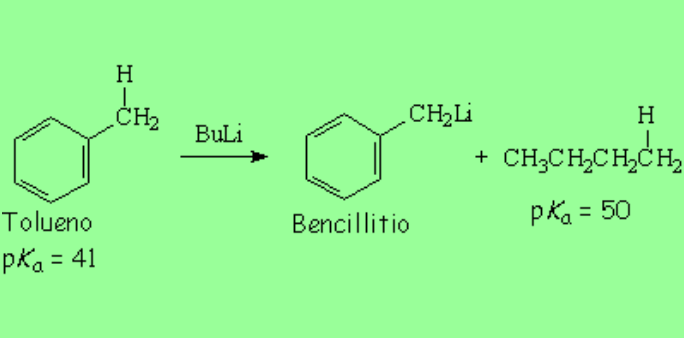
El tolueno puede perder un protón del metilo, que es un carbono sp3 aparentemente normal, por acción de una base fuerte como un alquillitio, cuyos carbonos también son sp3.
El pKa del tolueno es 9 órdenes de magnitud inferior que el del butano (el tolueno es 1.000.000.000 más ácido que el butano) porque el carbanión bencílico está estabilizado por resonancia con el anillo aromático. Por ello se da con menos dificultad.
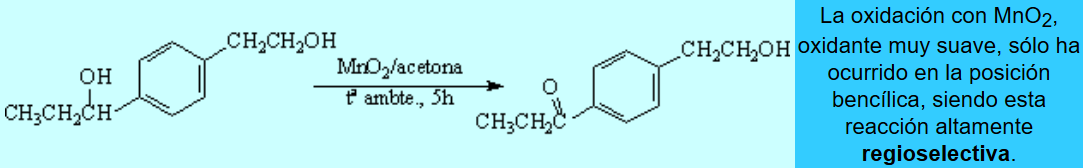
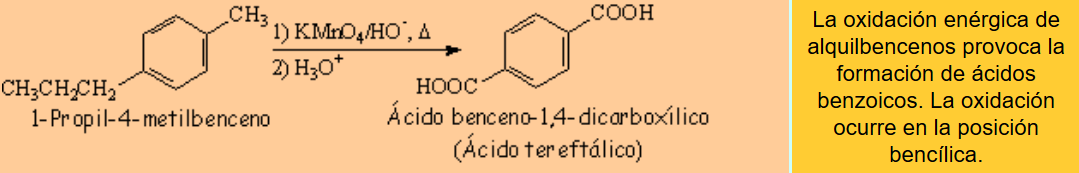
Los procesos de oxidación ocurren con mucha frecuencia a través de radicales libres. Por ello son especialmente fáciles en la posición bencílica.
Puede lograse la hidrogenolisis selectiva de grupos unidos a la posición bencílica de un anillo aromático como, por ejemplo, un éter.